尼康顯微鏡:全內反射熒光顯微鏡(TIRF)的結構
在熒光顯微鏡應用中通常采用的各種機制限制熒光團的激發和檢測的樣品的薄區域。 消除從焦平面以外的背景熒光,顯著提高的信號噪聲比,并因此,空間分辨率的功能或感興趣的事件。 全內反射熒光顯微鏡(TIRF)利用感應的倏逝波或場的有限的試樣區域,緊鄰兩個具有不同折射率的介質之間的界面的**性能。 在實踐中,*常用的接口在應用程序中的全內反射螢光顯微鏡的試樣和玻璃蓋玻片或組織培養容器之間的接觸面積。
TIRFM的基本概念并不是新的,和*近的興趣和熱情,技術已經到來,由于技術進步,促進其使用。 可用的完整的準備使用的儀器儀表系統的方法,以及在熒光基團的技術,比如基因編碼的熒光物種,發展就業使人們有可能在直接調查細胞膜和其它表面處理的數這在以前是不可能的方式。
TIRFM的物理基礎
全內反射(TIR)的物理現象已依賴在這種看似不同應用現代光纖的數據傳輸,并在百年歷史的鉆石切割利用率提高,切割的寶石閃閃發光,或“火”。 在每一種情況下,光的折射(或彎曲),當它遇到禁閉的一部分或全部的光的高折射率介質具有不同折射率的兩種介質之間的界面(n)的結果。 甲準直光束通過一種介質傳播,達到這樣的接口可以是折射的,因為它進入第二介質的界面處反射,取決于入射角,并在兩種介質的折射率的差異。 全內反射是*可能的情況下,在其中傳播的光遇到低的折射率的介質的邊界。 其屈光的行為是由斯涅耳定律:
n(1)×SINθ(1)=n(2)×SINθ(2)
其中,n(1)較高的折射率和n(2)的折射率低。 ,相對于界面法線與入射光束的角度θ(1)表示的,而折射光束角由下式給出θ(2)內的低折射率介質。 當光照射該接口的兩種材料在足夠高的角度,稱為臨界角(θ(c)),它的折射方向成為平行接口(相對于法線90度),它被反射在較大的角度完全返回到*介質。
雖然光不再傳遞到所述第二介質中時,它是在大于臨界角的角度入射時,反射光產生一個高度受限制的電磁場的界面附近,在較低折射率的介質中。 這漸逝場對入射光的頻率是相同的,因為它在強度與界面的距離呈指數衰減,該字段在*多幾百納米到試樣在z方向 (垂直接口)延伸。 在一個典型的實驗裝置中,在液體的玻璃或塑料液體表面附近的熒光基團,分布可以激發出的漸逝場,只要它們有潛在的電子躍遷的能量范圍內或非常接近的照明光束的波長帶寬。 由于漸逝場強度呈指數衰減,熒光團的激發是受限制的區域,這是典型的,厚度小于100納米。 通過比較,該光學部分的厚度是約十分之一,所產生的共焦熒光顯微技術。 避免因為大量的試樣的熒光團的激發,次級熒光發射限制到一個非常薄的區域,來實現高得多的信號對噪聲比較傳統的寬視場落射熒光照明。 這種增強的信號電平,使得它可以通過內全反射螢光顯微方法檢測單分子熒光。
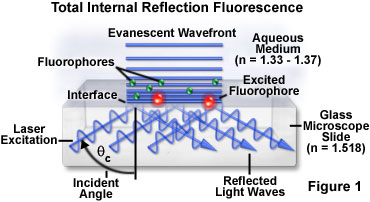
全內反射熒光的基本概念,是示意性地示出在圖1中,試樣的細胞結合的熒光分子(圖中的綠色的熒光基團),其中在玻璃顯微鏡載片上的支持。 在載玻片試樣介質水溶液(約1.35)(1.518)的折射率適當地支持全內反射,在玻璃載片上。 調整激光激發的值大于臨界角的入射角,照射光束被完全反射回時遇到的接口到顯微鏡載片上,緊接該接口相鄰的檢體介質中產生漸逝場。 *接近的玻璃表面的熒光基團被選擇性地激發的相互作用的漸逝場中,可以收集從這些發射器的二次熒光顯微鏡的光學系統。
正如先前所討論的,所采取的不同介質之間的界面處的折射或反射后傳播的光束的角度取決于光的入射角的界面處,以及這兩種材料的折射率。 發病率,*過該發生全內反射的臨界角,可以計算由斯涅耳定律的表達操縱,上面給出的。 應用方程細胞膜的過程的一個典型的生物調查,載玻片或蓋玻片的折射率由n(1)(約1.5)表示,而n(2)表示的折射率的緩沖水溶液或細胞質組件(1.33至1.38)。 具有n(1)比n(2),當θ(1)*過臨界角θ(三),會發生全內反射在玻璃介質。 上面的臨界入射角,折射發生在90度(罪θ(2)=1),斯涅耳定律簡化為:
n(1)×SINθ(C)= n(2)
或
SINθ(C)=n(2)/ n(1)
因此,在臨界角可以表示為:
θ(C)=sin-1 N(2)/ N(1)
不突然發生全內反射的臨界角成為一種新現象,但隨后用少量的反射,*過臨界角時,總反射從主導折射的連續過渡。 朝著臨界角值隨著入射角的增大,傳輸(折射)光束反射光束強度減弱,而變得更加**。 在所有大于臨界角的角度,總的內部反射來實現,其中基本上所有的光被反射回所述*介質。 即使不再光傳播到所述第二介質中,有少量的反射光通過該接口,然后平行于表面的傳播,創建一個電磁場在緊接該接口相鄰的第二介質的滲透。 這個字段是被稱為漸逝場,并在有限的界面附近的區域,它是能夠令人興奮的熒光基團。 在z方向上(垂直于界面)的指數衰減的倏逝波的能量激勵的范圍是有限的。 下面的公式定義這種能量的距離的函數,從該接口:
E(Z)= E(0)exp(-z/d)
其中,E(z)是在從接口的垂直距離 z和E的能量(0)是在界面處的能量。 的穿透深度(d)不依賴于入射照明光的波長(λ(i))的入射角,和在界面處的折射率的介質,根據公式:
在小的入射角,通過該接口的較低折射率介質傳播的光波的正弦,有一個特征周期。 在增加角度,接近臨界值,這個時期的折射光線變長,變得更接近平行于界面的傳播方向。 當達到臨界角,波周期變得無限大,折射光的波陣面垂直于界面的表面對齊。
要總結,有幾個關鍵因素支配的倏逝波在顯微鏡的利用率。 全內反射的發生,并且產生的漸逝場中的照明發病率的介質的折射率必須是大于檢體介質(比n(2),N(1)),光的入射角(θ (1))必須是大于臨界角(θ(c) )。 入射照明光波長的影響倏逝波的穿透深度和特定的被激發的熒光基團,其中必須有適當的吸收特性的光源的波長帶中。 的含意結合的倏逝波的能量呈指數下降的事實,在z方向上的波長的影響,可以誘導在一個非常薄的光學部分,通常小于100納米的厚度,高度特異性熒光激發。 盡管是有限的全內反射螢光顯微鏡成像具有合適的折射率的兩種不同介質的界面處,大量的應用是非常適合的技術。 在生物醫學領域的研究興趣是*活躍的領域之一,其中許多引人注目的問題涉及過程發生在細胞表面或血漿膜 - 適當的接口TIRFM調查。
TIRFM基本儀器的方法
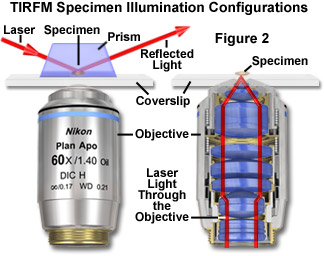
有兩種基本的方法配置儀器的全內反射熒光顯微鏡:棱鏡法 ,和物鏡方法 。 圖2說明了這兩個配置。 在棱鏡技術,聚焦的激光束被引入到顯微鏡蓋玻片通過附在其表面上的棱鏡,光束入射角被調整到臨界角(參見圖2(a))。 依賴引進光束在棱鏡有許多限制,主要是由于到標本操縱的幾何約束,盡管該方法在生物應用已動用*過二十年,它從來就沒有成為一個主流研究工具。 棱鏡配置有許多變化,但大多數限制訪問試樣,使其難以執行操作,注入介質入檢體空間,或進行生理測量。
棱鏡技術的另一個缺點是倒置顯微鏡設計的基礎上,在大多數配置中,被引入的照明在試件上的相反側的目標的光學元件,需要通過大量的試樣的漸逝場區域成像。 放置棱鏡的標本,以避免這種情況的客觀方面提出更多的問題,因為靠近一個短工作距離目標的標本和棱鏡位置。配置利用全內反射成像系統的復雜性和精度要求阻礙了許多潛在的研究人員從顯微鏡制造商提供完整的系統(“交鑰匙”)成為前。 需要調查誰想要利用技術,設計并建立自己的系統,這個困難,結合的必要性,建立和維護一個開放的激光光學平臺上,這意味著更早版本的用戶更經常棱鏡方法物理學家比生物學家。

所述物鏡的技術,它有時也被稱為通過透鏡照明 ,避免了許多設計上的限制,利用這樣的棱鏡引入光在所要求的角度(參見圖2(b))。 在該方法中,客觀上介紹無論是相干激光或蓋玻片試樣界面的非相干弧燈照明。 的入射角大于臨界角的實現通過使用高數值孔徑的目標(理想情況下為1.45或更高)。 通常情況下,被認為是一個客觀的數值孔徑的特征的光收集能力的鏡頭。 相反,直接的數值孔徑決定的角度范圍內的光可以退出該目標時,它是利用一個提供照明。 數值孔徑和可實現的照明的入射角之間的關系由下面的公式描述:
數值孔徑(NA)= n×sin(θ)
其中,NA是物鏡的數值孔徑,n表示折射率,θ是二分之一的物鏡的孔徑角。 結合上面給出的全內反射條件的關系,示出該活細胞具有典型的折射率為1.38需要一個客觀的,具有大于1.38的數值孔徑,以實現全內反射的照明。 光線進入的目標必須通過的孔徑錐部對應于數值孔徑大于1.38的值,以上面的玻璃試樣界面被全反射。 如果采用相干激光照明,它必須集中在目標后孔的周邊,保證燈將退出上面的角度等于或大于臨界值的前面的光學表面。 在非相干照明,例如以從一個弧放電燈的情況下,在一個不透明的磁盤的形式的掩模必須被引入到光路中,以限制的目標的光通過后孔的外部區域。
通過限制在物鏡的后焦平面的圓形環隙區域的照明,照明錐的中心的光線,通常會出現在亞臨界角被擋。 由此產生的排放物的目標是一個中空的圓錐體入射的光的后半的角度足以造成全內反射的TIR接口。 如果顯著的照明的目標后孔(較低的數值孔徑區域)的中央部通過,落射照明,而不是全內反射,降低在圖像平面上的信號 - 噪聲比。 在實踐中,不透明的阻光磁盤可以被安裝在一個可移動的滑塊,促進TIRF和落射照明成像模式之間快速切換。
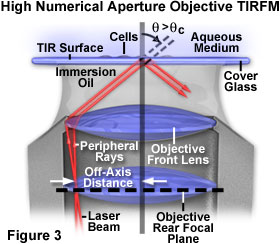
實現漸逝場激發通過使用高孔徑物鏡,在試樣的操作和測量選項提供了更大的靈活性比棱鏡為基礎的技術,但入射照明角度的精確控制是比較困難的。 當一激光源,用于耦合到棱鏡的光的入射的角度可以很容易地在很寬的范圍內變化,可以簡單的控制的漸逝場的穿透深度。 與物鏡系統,在客觀的后側焦點面上的激光的聚焦點的偏軸(利用的開口的外周部),和從透鏡軸的徑向距離增加,產生一個相應的角度的增加,在光入射到試樣上的(參見圖3)。
如果物鏡的數值孔徑足夠大,則可以實現全內反射的臨界角。 ,因為主要的細胞成分(細胞質中)具有約1.38的折射率,物鏡的數值孔徑*過該值是必需的。 只有百分之幾的鏡頭的周邊區域有一個1.4的數值孔徑的目標,可以利用全內反射的臨界角的只能稍微*過,進入后孔的一個非常具有挑戰性的程序耦合的激光。 顯然,更高的數值孔徑的目標是有利的,并提供額外營運利潤率*過臨界角的角度微調。 一旦*過臨界角時,鏡頭的光軸的激光焦點的徑向距離的進一步增加,以減少在一個光滑的和可重復的方式漸逝場的穿透深度。
TIRFM應用
在一般情況下,總的內部反射照明具有潛在的好處,在任何應用程序需要標本中有大量的熒光基團位于分子在溶液中的布朗運動的興趣愛好,如光學平面以外的微小結構或單分子成像,囊泡發生內吞作用胞吐,或單細胞蛋白質販運。 這樣的樣本通常表現出急劇增加,信號噪聲比的限制,激發區域的厚度。 圖4表示的利用TIRFM技術方法(圖4(b))和常規落射熒光照明(圖圖4(d))的溶液的熒光微球獲得的圖像。 到左邊的每個圖像是其對應的的強度直方圖(圖4(a)和圖4(c))。 在影像中,在尖銳的本地化和較高的信號強度在直方圖中對應的全內反射螢光顯微鏡圖像(圖球體從1.3到35所提供的信號-噪聲比(S / N)增加分辨率的提高是明顯的圖4(a))。
人們很早就認識到,全內反射螢光顯微鏡在回答了一些生物的問題可能會成為一個**的工具,雖然使用了20多年,該技術已得到了相當多的關注,直到*近。 電池基板接觸人體皮膚成纖維細胞,標記用熒光血脂,TIRFM在20世紀80年代初進行了調查。 在大約相同的時間利用TIRFM技術的組合進行的另一項研究中,用熒光漂白恢復(FRAP)澄清生物分子的表面動力學,同時仍然集中在綁定到表面的能量轉移的牛血清白蛋白。 結合,后者的研究的TIRFM與熒光共振能量轉移(FRET),另一種技術,目前正經歷著快速增長的應用程序。
TIRFM和其他**技術更多地利用的趨勢是由于供應量增加,使得它不必要的工程師,為每個特定的研究應用,并構建定制系統*的模塊化儀器。 另一個重要因素是,可以適用于各種各樣的問題,其中*重要的,這可能是利用綠色熒光蛋白(GFP),青色,藍色,黃色和紅色的衍生物的多功能生物工具的發展。 來源于水母的綠色熒光蛋白,不要求種屬特異的輔助因子表達和展覽的熒光,可用于跨物種實驗。 生物的熒光基團已被插入到數百蛋白質,通過基因重組,并且本質上是無限的,潛在的。 另一個有希望的GFP突變體的發展能力的結果作為神經遞質釋放過程中的細胞內鈣指標的功能。 這些蛋白質已監測在一些研究中,通過熒光共振能量轉移。
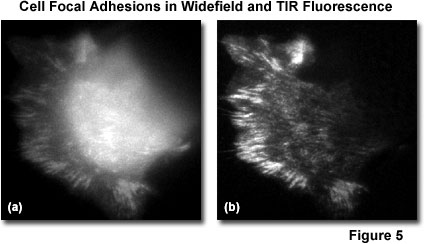
TIRFM是一個理想的工具,進行調查的機制和動力,許多參與細胞 - 細胞相互作用的蛋白質。圖5給出比較圖像的活細胞(PtK1袋鼠腎上皮細胞表達GFP-紐)利用傳統的廣角落射熒光法(圖5(A))和漸逝波照明(圖5(b))。 TIRFM圖像顯示融合蛋白在細胞粘著斑由平面熒光落射照明圖像產生模糊的巨大反差的是在襯底界面的本地化。 活細胞成像代表TIRFM技術*有前途的應用之一。 蛋白在細胞膜表面的相互作用,如涉及焦點粘連,它具有極大的重要性,在細胞生物學。 理解正常的細胞生長和其衰減造成的細胞 - 細胞接觸(接觸抑制)中所涉及的信號可以提供異常細胞的生長中發生的疾病,如癌癥的洞察。
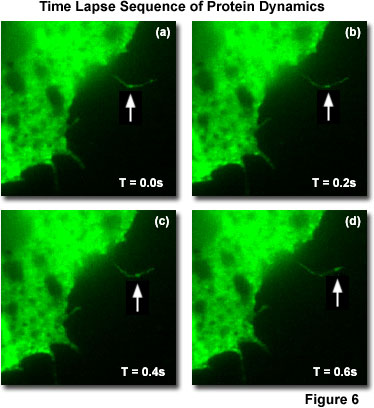
生物分子水平的,全內反射螢光顯微鏡技術已被用于圖像的突變蛋白的GFP-消旋販賣沿薄絲狀偽足的細胞生長在基板上(圖6)的單分子。 這種蛋白是參與細胞運動,其在細胞膜的相互作用的動力學的知識是至關重要的了解的過程。 有足夠的時間分辨率動態研究的可視化單分子熒光TIRFM,因為懸而未決的倏逝波激發所帶來的信號噪聲比。 圖6給出的四個連續時間的推移在200毫秒的時間間隔拍攝的幀,示出了運動的GFP-Rac的融合蛋白分子(箭頭)通過細filopodium的一個爪蟾的細胞生長在襯底上。
TIRFM雖然是有限的調查蓋玻片標本接口或附近發生的結構和流程,它是目前在生物和生物醫學科學的興趣,很多問題可以探討在細胞膜同時偶然。 神經科學領域的許多根本問題借給自己TIRF顯微鏡研究。 應用該技術的一個理想的候選人是在突觸神經遞質的釋放和吸收的研究。 從歷史上看,膜販運和融合的機制,包括突觸囊泡釋放(胞吐)或攝取(內吞作用),已使用遺傳,生化,電子顯微方法研究。 這些技術在某些方面是間接的,或僅提供一個瞬時表示所發生的程序,無法解析的細胞膜活性的復雜動態。
膜片鉗技術的發展已經允許電容測量可用來指示,由非常小的電變化,膜表面積或氧化物質的釋放的加法或減法。 這種技術的缺點是,只有融合事件被檢測到,和高時間分辨率的同時,可以實現,有很少的重要事件的空間位置上的信息。 由于所有的事件一起被檢測到,得到無特異性和囊泡運輸對接,和膜融合的其他階段的細節通常被結合動力學模型推斷,從小區的測量。 雖然電子顯微鏡調查提供了出色的空間分辨率,活細胞或動態的研究是不可能的,與其他測量瞬時意見的相關性是非常困難的。 強度的TIRFM方法,證明在*近的調查中,可能是直接肉眼觀察動態囊泡蛋白相互作用。
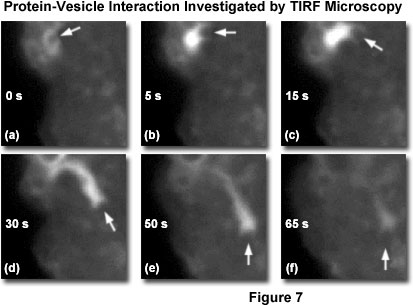
TIRFM由于個別囊泡光學解決,按照它們之間的相互作用,直接動態的能力,提供了*的大量的蛋白質參與的方式在神經生物學過程研究的能力。 *近的一項研究表明釋放的熒光脂質含有突觸船只活動區域,以及隨后從儲備庫位于20納米從質膜提供補充盜號木馬的囊泡運輸的。 另一項研究涉及直接可視化培養的肥大細胞的內吞作用的動態過程中肌動蛋白的作用。 GFP-肌動蛋白絲,觀察周圍的熒光標記的胞飲囊泡,進入細胞內的肌動蛋白的流中拉出。 一時間推移TIRFM成像序列圖7說明GFP-肌動蛋白的內吞過程中。 的6個連續的幀表示在0到65秒的范圍內的不同的時間間隔。 在每個幀中的白色箭頭表示的GFP-肌動蛋白的融合蛋白的信號。
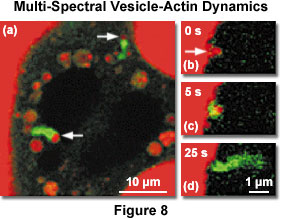
在圖8中示出的多光譜成像囊泡-肌動蛋白的內吞作用過程中的相互作用。 在這兩個通道的圖像(圖8(a)),一個流的綠色標記的GFP - 肌動蛋白被認為是在細胞外介質中的囊泡含有德克薩斯紅葡聚糖周圍。 一時間的推移三個雙通道圖像序列(圖8(b)至8(d)條)提供了洞察時間動態的肌動蛋白囊泡的胞飲過程中的互動。 這種類型的研究邏輯上可以擴展標記突觸蛋白,利用不同的GFP顏色的變種,以調查他們的互動和動態。
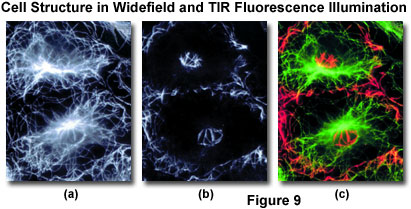
雖然試樣中的全內反射螢光顯微鏡中成像在二維空間中,有可以得到在細胞的囊泡或結構上的位置的三維信息的機制,其中,無論是在活細胞研究和在固定染色制劑。 圖9示出了在細胞結構蛋白的微管蛋白的免疫細胞化學標記,想像同時使用寬視場落射熒光(圖9(a))和瞬逝波照射(圖9(b))。 結構的細節揭示在TIRFM技術的圖像,不能進行可視化與常規落射照明。 比較兩個圖像模式所強調的是覆蓋在偽。 在圖9中(C),螢光分配的顏色為綠色,而TIRFM圖像顯示為紅色。
全內反射螢光顯微鏡的原理,通過改變照明的入射角,并因此對倏逝波的穿透深度,熒光基團可以被區分納米尺度上的深度。 這種技術可以精確地控制穿透深度更容易棱鏡類型的系統中來完成的,*近的技術改進的方法是利用聲-光偏轉器(AOD),快速地改變入射角。 在漸逝場深度的快速變化,目標囊泡或其他結構可以跟蹤在不同的深度和準確地確定它們的位置。有很多方向AOD中的全內反射螢光顯微鏡,包括用作極快的快門,可以快速地調節照明波長的多線式激光裝系統的潛在的有用的應用程序。
如上所討論的,在目標為基礎的系統中的入射角的變化是不容易在使用棱鏡來完成,雖然新的更高的數值孔徑的目標提供了相當大的改進,在可用的范圍內的入射角調整。 在一般情況下,目標類型的系統能夠檢測更多的發射光,并且這個信號的強度隨距離單調減小。 該屬性是一個優勢,在校準的TIRFM技術的系統,可以使熒光信號電平有關的軸向位置,提供了另一種方法,三維成像。
未來發展前景
TIRFM的基本理論,現在成立,*近的技術進步大大促進了該技術已實際執行。 因此,越來越多的生物分子和細胞生物學的調查正在使用的技術進行。 TIRFM技術的系統結構的基礎上直立或倒置顯微鏡是相對簡單的,使用的激光光源,并且可以通過使用傳統的弧燈源,如果進行了修改,以阻止光通過的中央區域的目標。 TIRFM配置與其他光學技術結合,完整的模塊化顯微鏡系統,現在,有的廠家專門為內部反射的應用提供了高數值孔徑物鏡。 具有廣泛的照明模式,包括明,暗場,相襯和微分干涉對比,以及常規落射熒光的內全反射螢光顯微技術兼容。 的目標為基礎的系統的一個特別的優點是,它們可以被用來結合用于處理生物分子的各種機制,如原子力顯微鏡。 它很可能是全內反射螢光顯微鏡將繼續被合并與其他技術互補。
收購在活細胞在多個波長的高時空分辨率的圖像數據是一個面積的TIRFM大有希望,一定要更詳細地比以前一直未能揭示細胞動力學和擴大利用各種染料組合。 *近,研究者已經報道利用雙發射波長檢測,可以在一個單一的波長激發的熒光基團,并通過配置系統的多波長激發TIRFM能力進一步擴大的可能性是存在的。 單分子研究,將大大提高染料特性的進一步發展和持續改進的探測器。 在細胞研究的TIRFM方法的擴展可能繼續通過細化的遺傳和分子操縱技術,結合所提供倏逝波激發的高時空分辨率的光學檢測。
TIRFM和激光掃描共聚焦顯微鏡(LSCM)由于有一定的通用功能,這兩種技術進行評估時,自然比較可能的方法來研究問題。 雖然這兩種技術提供了光學切片能力,全內反射螢光顯微鏡的方法是有限的試樣區域,具有一個合適的折射率界面,而共聚焦顯微鏡可以選擇性圖像幾乎任何試樣平面。 然而,共聚焦方法所產生的*小的光學部分的厚度是約600納米 - 厚度大于100納米的部分的內全反射螢光顯微技術的典型。 在許多應用中,它是希望到標本(減輕細胞損傷,例如),以盡量減少總的照明通量,因為共聚焦工具照亮一個比較大的標本量,這是與全內反射螢光顯微鏡更容易地完成。 在一般情況下,它是更經濟的配置TIRFM技術的儀器,它不需要復雜的掃描系統,可以建在幾乎任何現代光學顯微鏡研究級。 完整的,配置系統的一些廠家所提供的是*直接的進入點TIRFM技術,并允許其他**的光學成像模式的綜合能力。
d = λ(i)/4π × (n(1)2sin2θ(1) - n(2)2)-1/2



