尼康顯微鏡:光譜成像和線性分解
在過去的十年中,已經開發了廣泛的高性能熒光在熒光顯微鏡調查采用了*的技術,如激光點掃描共聚焦,旋轉盤,多光子,總的內部反射。現在可用的*探針基因編碼的熒光蛋白,半導體量子點,膜透性的合成熒光基團組成的混合動力系統,物鏡蛋白融合,和單機的人工合成,具有廣泛的物理和光譜性質。這些試劑能夠針對幾乎任何在活的或固定細胞中的蛋白質或肽的許多也是很有用的生物動力學指標。當用作單一的標簽,成像大多數熒光團很簡單,可以很容易地實現與標準照明器和熒光過濾器集。然而,當使用兩個或兩個以上的熒光探針的組合時,調查員應該知道在檢測通道中的潛在信號交叉的發生是由于熒光團之間的光譜重疊。
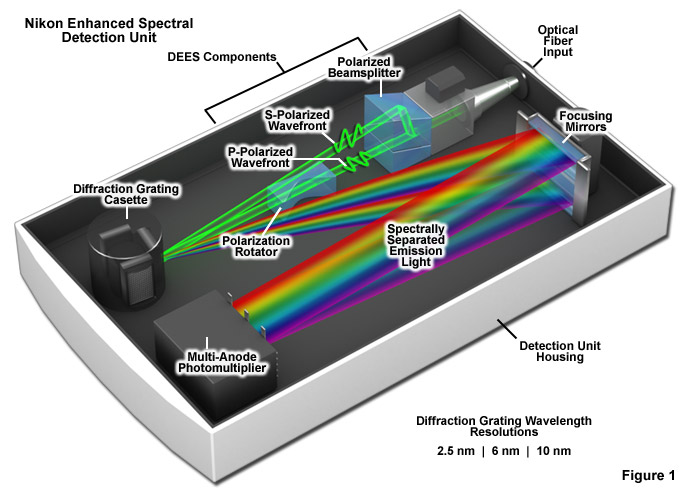
高級研究顯微鏡能夠在一次實驗中使用單,雙,三或四波段的雙色鏡以及相關的激勵和的發射濾光片集,正在分析的探針的發射光譜剖面相匹配的多個熒光成像。不幸的是,許多合成的熒光基團和熒光蛋白的發射光譜的檔案跨越范圍從約50納米到150納米的波長帶,從而擴散到發射信號從用于另一個檢測通道的一個探針插入的潛力。情況就復雜了進一步的熒光探針的選擇是有限的,或兩個以上的熒光蛋白,同時在相同的試件進行調查對象。由于研究多個探針在起居室和固定細胞之間的相互作用所提供的信息的級別顯著高于單獨使用相同的標簽的情況下,方法已發展解開發射信號的復雜的混合物,使光譜可以單獨解決。在這方面*的字段是一種技術被稱為光譜成像耦合數學上線性分解所測得的光譜中,表示目前可作為市售各種各樣的輔助硬件和軟件組件的光學成像和分子光譜的協同聯合廣角和激光掃描共聚焦顯微鏡。
如圖1所示是一個高性能的尼康A1共聚焦顯微鏡光譜檢測裝置,可以使在單次掃描多光譜高速采集的剖面圖。的光譜檢測器是連接到掃描單元通過的光纖,具有波長分辨率獨立的共焦針孔的直徑。首先通過一個專有的衍射效率增強系統(簡稱DEES)為兩個正交的偏振光的波陣面(稱為P和S),使用一個偏振分束器分開進入的非偏振光的發光的熒光發射光進入探測器。DEES系統的目的是為了增加光的衍射效率由光柵用于分離成不同波長的熒光發射。離開分束器后的p -波陣面旋轉90度(到一個S -偏振波),使用棱鏡系統和兩個光束然后由三個可互換的光柵衍射。的衍射光柵,可以精確地控制,以確保高度的重現性,波長分辨率為2.5,6,和10納米。使用10納米的光柵,光譜在320納米的范圍內,可以在單次掃描方式獲得。由光柵衍射光譜不同波長的重點由兩個獨立可調的圓柱形鏡,聚焦點產生的每束(正常的s和旋轉P波)重疊到一個32通道多陽極光電倍增**。一個專門的屏蔽機制,可同時混合熒光激發了四個激光器。
在許多應用中,光譜成像,加上受益于基于軟件的線性分解算法是那些需要破譯個人光譜吸收染料和熒光基團在一個顯著的光譜重疊程度發生的情況下,大量的各種型材的能力。調查涉及活細胞成像(在動物和植物),免疫,染色體核型分析,臨床病理,流式細胞儀,體內成像和藥物發現可以提高使用光譜成像方法。的光譜信息:使用這種技術經常可以區分測量的工件,例如自體熒光,折射率的波動,沒有料到的熒光基團的相互作用,和環境的不均勻性,并獲得所需的信號從探測目標的實驗協議。除了 從實用程序,在去除不需要的自發熒光,可以掩蓋的細節在許多標本,光譜成像也是一個顯著的優點,在分離的重疊發射光譜的熒光蛋白和其他的熒光基團,在動態的熒光共振能量轉移(FRET)的實驗中,這往往是復雜極其快速的圖像采集的要求。
熒光串擾
這取決于分子結構和元素組成的微妙細節,任何特定的熒光基團的熒光發射光譜可以分布在很寬的波長范圍內,30和200納米之間的變化。為了說明這個概念,“通用的”吸收和所產生的一個假設的熒光基團的熒光發射光譜如圖2所示。本圖所示的光譜特征是共同所有熒光發射輪廓近似(但不完全)“鏡像”的吸收輪廓。在更短的波長區域的光譜輪廓的發射光譜具有量子產率急劇增加的曲線接近*大值的(稱為峰值發射波長)。光譜曲線的峰值,作為波長繼續增加,斜率更為緩慢下降,直到達到一個*低值后,返回到基線。光譜輪廓的寬度測定熒光發射的帶寬一般在*大的量子產率的50%,通常被稱為的半峰全寬(FWHM,圖2)。然而,在圖2中從檔案中可以觀察到,在這個區域之外,在較長的波長(在某些情況下,*過100納米)而產生的熒光發射量可以是顯著的。
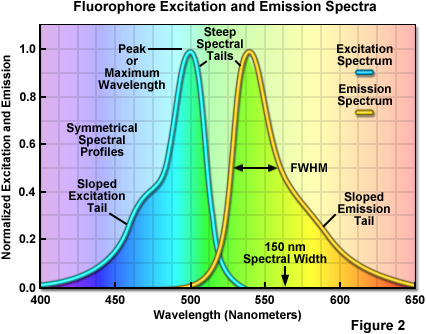
具有單個熒光在熒光顯微鏡中成像時,可以一個長通排放過濾器用于收集在一個寬的光譜范圍內的*大排放量。在這種情況下,不必擔心由另一熒光團所產生的排放重疊的信號的干擾(通常稱為交叉,滲色,或串擾)。然而,當成像的多個熒光標記,同時,發射的檔案經常共享相同的光譜區域,特別是在較長的波長,需要限制排放波長的帶通濾波器的中心附近的單個熒光基團的峰波長的限制,或優選消除,從其他的熒光團的發射的不必要的檢測。即使在使用窄帶濾光片,從一個熒光發射進入檢測通道用于另一個流血。成像時,兩個或兩個以上的熒光蛋白質中,經常發射光譜,使用合成染料或量子點,具有窄的發射光譜公司(通常為30至60納米)時,此問題不太嚴重,但變得更為嚴重跨越幾百納米。請注意,在整個可見光譜區域的寬度被限制為約300納米(從約400到700納米)。因此,同時成像的兩個分離的熒光蛋白,每一個具有跨越150納米的發射光譜公司,導致了一個顯著部分在可見光光譜的檢測信號。
熒光發射的電平信號,可以檢測到確定的寬度的發射濾波器的通帶和熒光團激發的效率的一個因素,是由耦合的熒光團的激發濾光器的通頻帶寬度的吸收光譜的檔案。其結果是,即使是在熒光基團的情況下,在其發射的檔案中有顯著的重疊,它們可能不產生可檢測的串擾,如果激發光濾光片的波長通帶特性都經過精心挑選。此外,由于激勵效率急劇下降的事實,在波長比周圍的吸收峰(見圖2),熒光基團具有的*長波長的吸收特性往往可以專門興奮沒有同時令人興奮的熒光基團,在更短的波長的吸收。例如,當成像增強型青色(ECFP)和黃色熒光蛋白(EYFP)(具有高度重疊的發射光譜;參見圖3(b)),可以盡量減少串擾*激勵和檢測EYFP,其次是成像的波長較短的ECFP使用激發和發射濾光片設計,以盡量減少激發EYFP。這種技術依賴于使用帶通發射過濾器,通常可以檢測只有大約50%或更少的可用由每個熒光團發射的光子的順序成像。此外,這樣的做法不會有效使用熒光基團(如ECFP和EGFP;參見圖3(c)),有太多的光譜重疊或不尋常的斯托克斯轉變時。
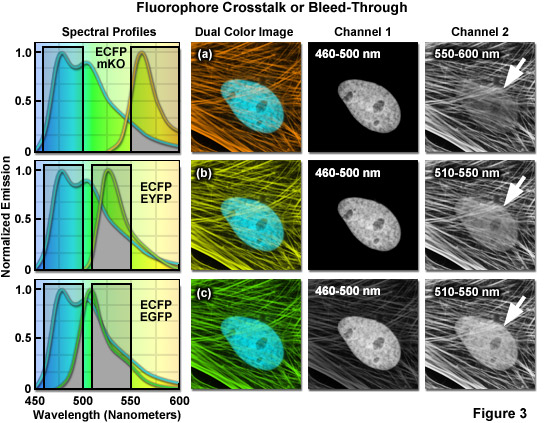
圖3中所示的計算機模擬的活細胞表達兩種熒光蛋白的幾種組合的示范頻譜交叉熒光成像。這些細胞是印度麂鹿皮膚成纖維細胞在細胞核中表達ECFP(頻道1),無論EGFP,EYFP的或單體Kusabira的橙色熒光蛋白(MKO)β -肌動蛋白細胞骨架細絲融合(通道2)。光譜重疊的區域中為每個探頭組合表示的濾波器窗口內的灰色區域中的頻譜圖。這些熒光蛋白組合展示出不同程度的發射光譜重疊。ECFP和人民圣戰組織(圖3(a))相結合的展示*少量的重疊和ECFP-標記的細胞核并沒有顯示通道2中的主要信號(通道)人民圣戰組織。ECFP和EYFP的組合(圖3(b)條)與此相反,具有相當多的重疊,在通道2中較為清晰和細胞核。*后,ECFP和EGFP的組合演示光譜重疊程度*高的(圖圖3(c)),在通道之間有顯著的信號交叉。
嘗試使用三個或更多的熒光蛋白,可在一次實驗中,需要使用更加高度受限制的激發和發射濾波器策略。兩個或兩個以上的熒光基團的結果,在一些不良后果,包括速度的限制,由于連續成像的必要性,在大多數情況下,成像的靈敏度降低為較小的濾波器的通帶的大小,和更復雜的標記策略是必要的,以減少光譜重疊的結果。收集圖像順序,需要更多的時間比同時成像和業績的快速采集過程中試樣的運動,可以妥協。此外,在活細胞中的熒光信號電平往往是低的,尤其是對于稀疏目標豐度表達內源性水平的標本。其結果是,使用有限的通帶過濾器的檢測可以是具有挑戰性。的信號與噪聲的的未混合數據集往往*過排放窄帶帶通濾波器獲得,因為整個150納米熒光探針的發射帶寬可以樣品,而不是只是一個狹窄的30納米發射窗口。*后,熒光蛋白調色板仍然是相當有限的,并在寬的發射公司很難干凈地分離排放或其他需要專門的過濾器集。因此,在活細胞成像高速數據采集往往是在一個實驗成功的關鍵任務的因素,這些后果可以有嚴重影響的調查結果。
光譜顯微鏡
光譜成像顯微鏡和光譜學的學科合并成一個組合,使確定的強度和光譜圖像中的每個像素的標本。在成像的*近的技術進步產生的高度復雜的數碼相機和點源檢測器(光電倍增管等),能夠以高空間分辨率和動態范圍的各種樣品,從眾多對比度增強技術,包括明場下創建信息豐富的圖像,相位相反,和熒光顯微鏡。這些探測器的進步也擴展能力創造合適的圖像依稀熒光標本,其先前失去了在本底噪聲低信號電平。與此相反,光譜法是一種行之有效的字段,包括收集和分析的定量收集在規定的波長頻帶的光強度值,它可以包括任何部分的電磁輻射光譜。顯微鏡,光譜成像技術通常只限于從近紫外到近紅外的波長范圍。
原子和分子,可以檢查與光譜儀的特性的能帶結構。簡單地說,光吸收的過程中,一個電子從基態激發到更高的能級,從它可以通過幾個途徑,包括衰變到基態與低能量的光(熒光)相關聯的排放量放松。的能量水平是每個分子的內在性質,因此該分子提供一個精確的光譜的指紋。熒光,特定的分子(稱為熒光染料或熒光團)連接到感興趣的結構,用作光源成像。在熒光顯微鏡中要注意的一個重要概念是,往往直接熒光基團的濃度和熒光強度的量的,尤其是在低濃度之間的線性關系。這種情況使定量分析的熒光,在必要的信號的情況下,可以成功地分開,飽和度,光轉換,光漂白效果,往往會干擾預期的線性。
不同于與熒光的情況下,在其他形式的光學顯微鏡,包括明場,增強對比度的傳播模式(相襯;霍夫曼調制對比度,HMC ;微分干涉對比,DIC),反射光,散射,試樣與外部寬帶照明光源和檢測器的測量相同的光后,與試樣相互作用。為了分析光譜數據,由所述光源發射的頻譜必須被考慮,所測量的信號通常是不成正比,除非它首先被轉換為光密度單位的發色團或在試樣的吸光物質的濃度根據比爾-朗伯定律。然而,大多數的細胞和組織染色吸收染料和成像的使用明場技術的光譜成像分析的總理候選人。
為了測量的光譜吸收染料,熒光基團,或完成試樣與多個標簽,傳輸或發射的光被分散成它的組成波長測定在各波長的強度或波長的帶寬很窄。光譜分辨率為每次測量的帶寬取決于作為采樣通道decreses的帶寬增加。各種不同的技術可以用于分散光,其中大部分已被應用的(至少在原型工具)顯微鏡場景。其中*重要的特征光譜測量時要考慮的是分辨率,波長范圍和動態范圍。光譜分辨率是由*接近的波長可以彼此區分的,高度精確的光譜成像測量的是一個關鍵參數。光譜范圍內是指在一個特定的測量波長(實際上,帶寬)的總數。*后,檢測限和動態范圍定義信號分別進行分辨的水平在一個特定的測量的尺寸和數量,所需的*低水平。所有這些值可以為每個熒光團或吸光物質的光譜輪廓的函數發生變化。
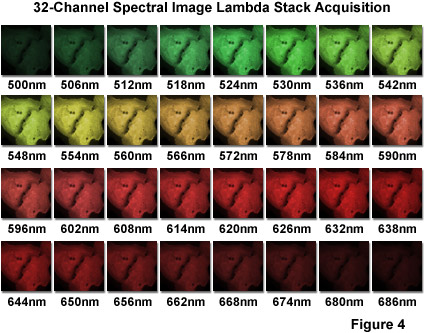
如圖4中所示,是在連續跨越500至692納米的波長范圍內,以產生一個lambda堆棧(在下面詳細討論),其中包含32張圖片6納米的帶寬獲得的一組典型的光譜圖像。樣品是培養貼壁人宮頸癌細胞(HeLa細胞線)中,用吖啶橙染色的DNA和RNA,并用尼康A1光譜共聚焦顯微鏡系統的成像。圖像(512×512像素),使用32個通道的多陽極光電倍增管以每秒24幀,使用488納米的激光激發記錄。如此高的采集速度,這是活細胞成像的重大利益,可以通過*的信號處理技術,再加上快速的模擬 - 數字轉換電路,隨著倍增。
光譜成像注意事項
*次出現在遙感領域的精密光譜成像技術由于要求分析衛星圖像數據所產生的反映,折射和散射的太陽光,以及陰影,在同一場景中。頻譜分析方法的目的是使從圖像數據集的多個頻率特性,為了區分各種景觀和地形的觀察對象。類似的技術用于其他應用,從研究材料的化學成分闡發恒星和星系的形成機制。因此,通過檢查作為譜頻率(波長)的函數的單個像素相關聯的,相匹配的光譜信息的強度波動,新的細節可以露天模糊簡單地分析單個圖像時,利用混合頻率的光捕獲。
在一般情況下,衛星和天體的數據集是具有一個或二個探針標記的生物標本的圖像所得到的復雜得多,因為光譜的類的數量通常是更大的。無論如何,衛星圖像的光譜特征是相似的檢查重疊的熒光蛋白在活細胞或固定的組織標本,標記的一些吸收染料(如曙紅,蘇木)的混合物時,所獲得的復雜性。在過去的幾年中,應用衛星成像的**方法已成功遷移到廣角和激光掃描共聚焦顯微鏡的一些應用,包括消除自發熒光文物生物標本的分析,檢測弱和卷積福斯特共振能量轉移(FRET)信號,在人類染色體核型分析,并為解開共定位的一個像素的像素的基礎上的熒光基團。將所得的光譜信息可以用于精確定位的位置特定的熒光基團和染料具有高空間精度,也可能能夠產生兩個或多個探針之間的相互作用信息。
在常規情況下,實驗協議許可,傳統的共焦和廣角成像技術可以成功應用于通過精心挑選的熒光探針和相關的過濾器集,以及通過實施適當的控制,以產生合理的分離,熒光掃描multitracking戰略信號。不幸的是,增加使用多個熒光蛋白的顏色與他們的關聯程度高的頻譜重疊監測細胞內的相互作用,往往限制了實驗參數的選擇。此外,在使用單個熒光活細胞成像,自然的自體熒光可以顯著干擾檢測通道,其中*流行的綠色發光的熒光探針(如增強型綠色熒光蛋白)是可視化。該背景噪聲問題也可能變得非常嚴重,通過使用固定劑或DNA轉染試劑引入多余的熒光。在熒光探針光譜明顯重疊或自發熒光過高的情況下,再加上收購后使用線性分解算法可以用來解開混合熒光信號,并明確解決的空間貢獻每個熒光圖像分析光譜成像。
光譜圖像拉姆達堆棧
類似的概念獲得厚的試樣,使用高數值孔徑物鏡的激光掃描共聚焦或反卷積顯微鏡的光學部分(或z棧的),拉姆達堆棧是一個三維的圖像集合中包括的數據集使用相同的試樣字段在不同的波長帶,每一個橫跨在有限的頻譜范圍從2到20納米的區域獲得。相比之下,典型的一切形式的光學顯微鏡的成像方案涉及收購(或時間推移實驗組連續圖像)的整個波長的探測器響應帶一個單一的形象。因此,盡管傳統的成像產生的圖像中的每個像素的強度值( I (的x,y)),用分光光度計測量只提供了一個頻譜( I (λ))。在lambda堆棧合并這些所提供的頻譜在每個像素的值(I (的x,y,λ)),以創建作為收集在一個不同的波長(或窄頻帶的波長,其中每個圖像獲取的圖像可以被認為),或作為不同的波長值在每個像素位置的集合。
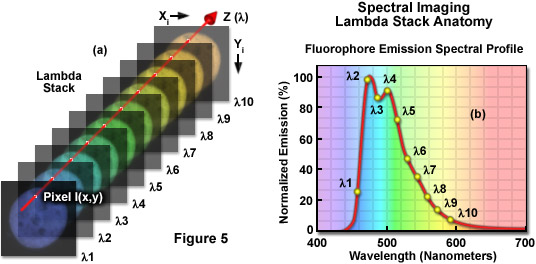
為了更好地理解的lambda堆棧的概念(通常也被稱為在文獻中作為圖像的多維數據集或光譜立方體),單個像素的位置在橫向的圖像尺寸(具有坐標 x 我 Y 我的),可以檢驗沿波長(?λ)軸。在圖5(a)的強度和/或顏色的像素我作為熒光發射的信號強度和波長的函數的變化,分 別如圖時,從一端的lambda堆棧的其他監視。通過繪制的像素強度與波長的直線圖形(參見圖5(b)條),空間位于像素的特定熒光團的發射光譜的檔案我可以很容易地確定。應當指出的是,使用這種技術獲得的發射光譜的準確度和分辨率是聚集在不同的波長帶的,在每個波長帶內的納米(較短的帶寬產生更高的分辨率)的頻譜寬度的lambda堆棧的圖像的數量的函數,根據調查樣本的身體素質和光子探測器的靈敏度(量子效率)。
圖6給出了一個真實世界的例子,激光掃描共聚焦顯微鏡用三個重疊光譜的熒光蛋白在活細胞上獲得一個lambda棧。本實驗中使用的熒光蛋白標記的增強型綠色熒光蛋白(EGFP從水母,*大發射波長在507納米),增強型黃色熒光蛋白(EYFP從水母,*大發射波長在527納米),和單體的版本:橙Kusabira(人民圣戰組織*大發射波長在561納米),一個高性能的探針,從天然存在的珊瑚蛋白開發。在這種情況下,個別的lambda堆棧的圖像進行掃描,在10納米波段的范圍從480至640納米(圖圖6(a)),生成一個共16光譜部分的熒光蛋白的混合物。
所述*圖像的lambda堆棧揭示了檢體中的發射范圍為480至490納米的光譜特征,而所述第二圖像包含從490至500納米(參見圖6(b))的排放數據。需要注意的是幾乎所有的來自兩個lambda在*部分熒光發射的短波長尾巴的EGFP單獨只有一個很小的EYFP在波長較長的部分(490至500納米)的貢獻。(500到510納米和510納米至520納米),在接下來的兩個lambda部分EYFP的貢獻穩步提高,EGFP的排放物達到一個高原。在520和550納米之間的三個拉姆達部分的開始,該EGFP信號的貢獻減小,從EYFP發射大約530納米處達到*大值。同樣,人民圣戰組織的排放貢獻變得更加顯著,在540和550納米之間的頻帶。因此,在550至560納米的頻帶,從熒光蛋白質的相對貢獻是約10,25,和65%分別為EGFP,EYFP,人民圣戰組織。
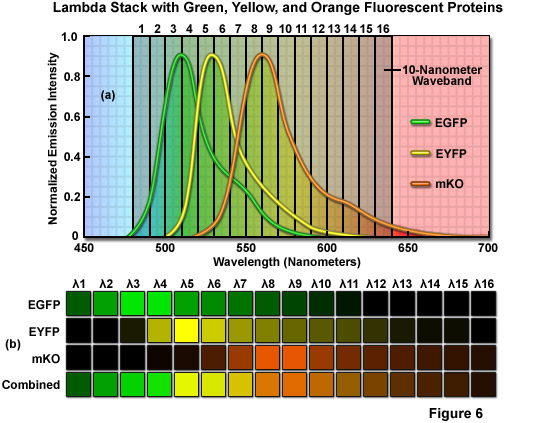
EGFP和EYFP成為人民圣戰者組織主導的排放物*終的波段(560?640納米)減少排放貢獻。我們回顧一下,在極端的lambda堆棧(480至500納米之間,在590至640納米之間)波段的功能,*短和*長波長的發光蛋白,EGFP和人民圣戰者組織,分別主要由排放貢獻。這些波長帶的中心的lambda堆棧(500到590納米),代表了一定的貢獻從所有三個熒光蛋白含有熒光。如下面將要討論的,在整個波長頻帶的lambda堆棧的混合發射信號的分布可以線性未混合使用參考從每個探針的發射光譜公司明確分開的貢獻的個體的熒光蛋白。
光譜成像技術
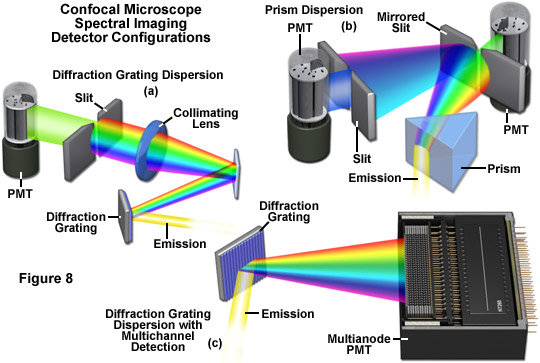
光譜成像光學顯微鏡的主要器樂代價包括能夠準確地分離熒光發射或光源光試樣吸收到它的組成波長色散元件或類似的技術。已經實施了許多不同的方法在廣角和共聚焦顯微鏡使用幾個探測器設計產生的lambda棧。已被證明是*有用的工具依賴于棱鏡或衍射光柵的光譜檢測器配備有分散,然后將其引導到一個或多個光電倍增管的熒光發射的激光掃描共聚焦顯微鏡。*的激光共聚焦儀器包含棱鏡或衍射光柵發射光束分散到其成分譜,然后傳遞到任何一個多陽極光電倍增管可以同時檢測多達32個獨立通道的光譜信息,或通過選擇波長狹縫一個檢測器,并反映了額外的狹縫較短和較長的波長。寬視場儀器利用干涉濾光器,聲光可調諧濾波器(AOTFs),液晶可調諧濾波器(LCTFs),干涉,棱鏡耦合到反射鏡,棱鏡或光柵,用于圖像分析產生的lambda棧。
在眾多的技術,已被用于生成lambda棧的,所謂的波長掃描方法代表可能是*簡單的方法。在實踐中,一系列的窄帶通干涉濾光器(通常為5至20納米的寬)用來收集每個過濾器的視場的圖像的堆棧。或者,可以組合shortpass和長通濾波器,具有特別尖銳截止波長的帶通濾波器來代替。在一些早期的光譜成像的共聚焦顯微鏡實現這種類型的配置,但已經被更*的技術所取代。使用過濾器時,帶通的大小確定 的λ掃描包括在每個波長的數目,因此,光譜分辨率。后車輪轉動到位(請參閱圖7(a))的新的過濾器的發射過濾器被放置在一個過濾器輪之間的試樣和檢測器,以獲得連續的圖像相同的試樣字段。一般情況下,基于過濾器的光譜成像技術是實用,僅有限數量的波段的情況下,必需的,因為試樣,必須反復掃描的每一個過濾器,而這往往導致過度的光漂白。此外,收集的lambda棧過濾器是一個比較緩慢的過程(至少需要幾分鐘),不適合用于活細胞成像所需的時間尺度。
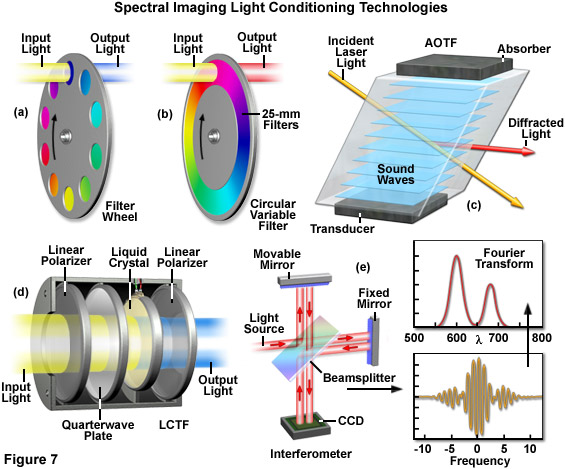
用于獲得波長掃描的λ棧的更方便的方法是使用可變濾波器(參見圖7(b)),可被精細地調諧,提供更多數量的波長帶,通常是更緊湊的過濾器的車輪。*廣泛使用的可變濾波器的配置是基于可變頻譜干擾濾波器和電可調諧的光濾波器。圓形可變濾波器包含的干涉濾光器,在空間上改變取決于入射光穿過過濾器的波長通帶。在實踐中,過濾器被放置在相同的位置作為一個過濾器輪,旋轉來改變通帶。無商業工具提供使用變量過濾器,可能是由于拉姆達的堆棧圖像包含一分鐘的疊加譜梯度表現濾波器設計的事實。但是,有幾個光譜檢測器提供的(參見圖7(c)和圖7(四))AOTF和LCTF設計的基于位置之間的可調諧濾光器的照明光源和試樣(當使用寬帶光源,例如電弧放電燈)或試樣和檢測器之間。不幸的是,樣品和探測器之間放置一個AOTF或LCTF可以導致貧困,由于極化和散射文物的傳輸效率。
AOTF和LCTF濾波器的的主要優點是,它們是電光學元件,沒有移動部件,濾光輪和狹縫的系統相比,能夠快速的切換時間。液晶可調諧濾波器的操作由安裝兩個線性偏振器之間,在一極化液晶施加電壓時,發射的窄帶波長。在大多數實現中,幾個階段要實現高分辨率的光譜分離的條件,也減少了在濾波器的通帶之內的總透光量。發送非偏振光(熒光發射)時,一個標準的LCTF具有約40%的光通過。如果*次通過的非偏振光通過偏振分束器,用于反射和透射的光的正交偏振的LCTF,效率可以提高一倍。過濾后的光,然后可以使用兩個單獨的檢測器檢測到或重新組合成一個單一的檢測器與另一偏振分束器,與圖像放置側的兩側或重疊(后者需要精確的注冊)。利用兩個偏振圖像的偏振熒光各向異性的圖像,可以是特別有用的,當進行FRET的熒光蛋白的測量使計算。
聲光可調諧濾波器采用一個專門的結晶化合物,如二氧化碲的晶格變形響應聲波。在每個聲頻,晶體變形,產生的衍射光柵,具有一個特定的期間,發送一個不同的波長(或窄頻帶的波長)。這兩個濾波器的設計產生一個lambda堆棧通過捕獲在不同的波長帶的連續的圖像的優點,并具有非常高的光譜分辨率。此外,操作員可以為每個單獨的波長帶中選擇一個*佳的曝光時間。在下行路上,AOTF過濾器可以是有問題的,如上所述,使用時發射光學列車(樣品和探測器之間)由于光線不好的吞吐量,以及圖像模糊和移位文物。一些制造商已經產生的圖像質量AOTF設備。也可以用來作為一種聲光可調諧濾波器可以在共聚焦顯微鏡的聲光分束器(AOBS),以取代通常的過濾器相結合的激光。AOBS使快得多波長切換比過濾器可以是特別有用的,當結合一個*連續白色光激光。
光譜成像時間掃描方法是基于獲取的數據集,它表示的光譜和空間信息的疊加,但還需要一個收集到的數據導出的光譜圖像的數學變換。在實踐中,該技術不要求的過濾器或棱鏡耦合的干涉計單元(圖7(五))在熒光顯微鏡進行傅里葉變換成像光譜通常被實現在寬視場顯微鏡。干涉的方法分割成兩個獨立的路徑的光的入射光束和兩個得到的光束之間的時間延遲引入的光程差。兩束光在到達探測器(CCD或光電倍增管),能夠干擾。通過測量強度的光程差為一個函數,創建干涉是特定的試樣的光譜特性。而計算出來的原來的頻譜施加傅里葉變換算法的干涉。成像光譜法的*顯著的優點是,收集整個實驗過程中,在各波長的強度的分辨率可調制只需通過調整采集參數。*的缺點是,即使在情況下,只有少數幾個數據點都需要,必須收集檢體的整個頻譜。一般成像光譜儀上進行定制工具,由于缺乏商業儀器。
流式細胞儀技術迅速推進,也可以從光譜成像技術中獲益。成像時,由于空間的限制流式細胞儀,光譜成像是通過選擇一個更小的感興趣區域(通常具有一個單一的單元的尺寸)和限制,以所收集的波長頻帶的數目進行的。因此,被分散的熒光發射的衍射光柵或定制的光學元件的表面上投影的時間延遲集成(TDI)CCD傳感器的像素時鐘同步的流量。類似的方法,利用電腦斷層掃描,全息分散元素投射到面陣CCD光譜和空間信息。在一般情況下,CCD照相機的速度與一個單一的lambda棧需要幾分鐘或更長時間的收集光譜成像是一個主要的限制。然而,出現了更快的系統可以幫助克服這些缺陷。數碼相機也需要重復掃描捕獲一個lambda棧,這可能會導致增加漂白和光毒性。更為重要的是在活細胞成像標記的結構可以改變空間位置在一個lambda堆棧消耗幾分鐘收購速度的情況。
在激光掃描和多光子共聚焦顯微鏡成像光譜
檢體的整個頻譜的應用空間掃描的光譜成像技術,可以同時獲取通過在一個單一使用點掃描或行掃描儀器。這種方法是特別有用的活細胞成像和探測厚的組織,那里的標本必須經常反復進行掃描,并因此接觸到大量的潛在的破壞性激發照明。空間掃描的光譜成像方法需要使用(圖8(a)和圖8(c))的衍射光柵或棱鏡(圖8(b))的分散體的熒光發射,并已被廣泛的使用在商用激光掃描顯微鏡和多光子。這些儀器通過棱鏡或光柵的色散,然后通過收集使用可變寬度的狹縫或多通道光電倍增器的選定部分的頻譜分離成它的組成波長的熒光發射。為了控制在共聚焦儀器配備有狹縫的波長選擇帶寬,光圈的大小是可調的。對于含有多通道光電倍增管的工具,衍射光柵的大小可以被改變(通過旋轉一個新的光柵具有不同的行間距到光學列車)控制進入檢測器中的每個信道的波長的數目。普通的到兩個儀器設計的存在下,以確保在所捕獲的頻譜缺乏的物理間隙的多個檢測通道。不管帶寬的大小,只限于由光電倍增管或通道的數量的數量的圖像,可以聚集在一個單一的lambda堆棧。
*通用的光譜成像的共聚焦顯微鏡的配置可以大大提高采集速度收集的lambda棧,利用多通道光電倍增管收集有限容量的波段熒光發射后,它已被分散使用衍射光柵(見圖8( c)條)。此次收購戰略已經成功實施尼康的C1si的A1共聚焦儀器,其中每一個都能夠高速只有一個單一的掃描光譜采集。多通道光電倍增管(通常稱為多陽極光電倍增管),這些工具包含一個線性陣列的單個10納米檢測通道建立成一個單一的單元,從而使多個發射帶并行成像,從而嚴重限制了標本漂白和光毒性。尼康光譜檢測單元具有與采樣增量2.5,5(或6),10納米,可以單獨的光路進行調整的頻譜帶寬的lambda部分旋轉到一些衍射光柵。分散的排放量,然后通過32個通道的多陽極光電倍增管的精確定義的通道每個通道生成一個單獨的圖像。熒光發射的總帶寬是由衍射光柵采樣增量決定:2.5納米抽樣產生一個80納米的帶寬,5納米光柵產生160納米的帶寬,而6納米光柵產生192納米的帶寬和10納米光柵產生320納米波段。在Nikon儀器,光譜成像檢測器的使用激光屏蔽機制,消除了來自激勵源的激光反射光的,和衍射光柵可以傾斜,以選擇任何的子采樣的帶寬。
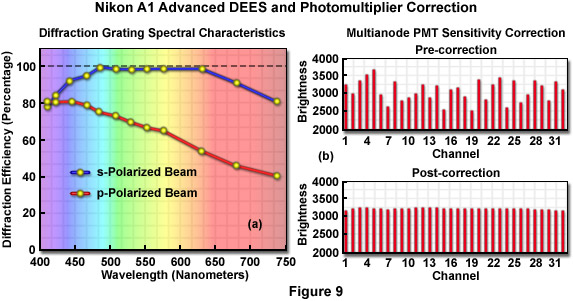
其中高性能成像光譜共焦顯微鏡的*功能尼康**的專有衍射效率增強系統(DEES),這是設計,消除兩極分化文物,光柵波長減少損失,并捕捉熒光發射的*大金額。DEES系統操作通過非偏振的熒光發射通過產生兩個分量的波陣面取向平行和垂直于入射平面的,分別稱為P和S偏振光的雙分束器的光學元件。*精通觀察到s -偏振光的光衍射效率,所以偏振旋轉器被定位在該途徑的s -偏振光的光的p偏振光的光而產生,顯著提高了工作效率的光柵系統。正如圖9(a)中所示,對偏振光的衍射效率是450至675納米的波長范圍內的90%以上。與此相反,S -偏振的光的效率是80%,在450納米和幾乎呈線性下降到約45%,在675納米。因此,尼康DEES系統可以顯著提高光的通過,因此,靈敏度,在光譜檢測單元。頻譜寬度的情況下,必須進行調整,可以進行額外的試樣掃描相鄰探測器通道可以組合(稱為分級),雙,三,或四重檢測頻帶的寬度。
雖然基于狹縫的光譜成像的共焦工具能夠在高分辨率成像的發射光譜,它們的速度相對較慢時相比,裝有與多陽極光電倍增管的顯微鏡。即使是那些工具的功能鏡像狹縫部分的帶寬,以反映第二或第三倍增仍然遭受缺乏成像速度為活細胞成像所需的時間尺度。在許多情況下,*過200納米的狹縫系統測量頻譜可能需要幾分鐘或更長時間,從而阻礙了光譜成像的標本,在整個拍攝期間,經過時間的運動。光譜成像顯微鏡的性能,*的功能,提高靈敏度校正在基于多陽極顯微鏡(參見圖9(b))。這些工具使用的基礎上可溯源的光源的發射線和亮度調整每個通道的波長精度校正。此外,光纖元件的端部和檢測器的表面都涂有一種特有的防反射劑,以減少信號的損失,并實現高的光傳輸。*后,*的雙積分信號處理(DISP)技術已被添加到圖像處理電路,以提高電效率,防止信號損失,同時數字化器處理的像素數據和復位。其結果,該信號被監測整個像素的駐留時間,從而顯著改善的信號-噪聲比。事實上,這些技術相結合使32通道光譜成像(512×512像素)每秒24幀的速度足夠快,為各種各樣的活細胞成像應用。
除了使用熒光發射光譜成像產生的lambda棧,這項技術也可以被擴展到利用下的熒光激發光譜特性調查。基于激勵的lambda棧,可以通過改變使用單一探測器收集熒光激發波長陪同收購。由于這樣的事實,排放聚集在一個單一的通道,通常是高的信號 - 噪聲比,并提出了一種用于數據處理的優勢。激勵的lambda棧分析使用相同的線性分解算法設計用于發射的光譜數據(見下文)。在一般情況下,一個寬帶激光光源能產生廣泛的線與快速切換的需要,收集高分辨率的激發的lambda棧,但更簡單的形式從不同的激光器可以實現使用多個單獨的線。激發光譜成像的主要缺點是相對緩慢的成像速度,來自順序波長掃描的要求。因此,該技術是成像時,更實用,而不是固定的細胞和組織為活細胞成像。在未來,*連續白光激光共聚焦顯微鏡,光譜成像使用激勵棧應該成為更多的主流。
光譜成像是一種新興的一個功能**的分析工具,在多光子顯微鏡,激勵源通常是一個連續可調的近紅外激光脈沖。的潛在能力,有效地分離的熒光基團與多光子技術是借助于一個事實,即許多具有高度重疊的發射光譜公司的熒光基團具有不同的多光子激發的顯著少的重疊光譜。在這種情況下,線性分解應該有分開的能力,熒光探針,否則將有太多的發射重疊待解決。熒光探針檢查時,如具有非常相似的排放概況的Alexa Fluor 488,熒光,和SYTOX綠色,遠遠低于光譜重疊其激發型材比在他們的排放概況,這樣的前景顯得尤為重要。多光子技術也可能有用的分離選定的熒光團的發射從藍色和綠色光譜區域的自體熒光。
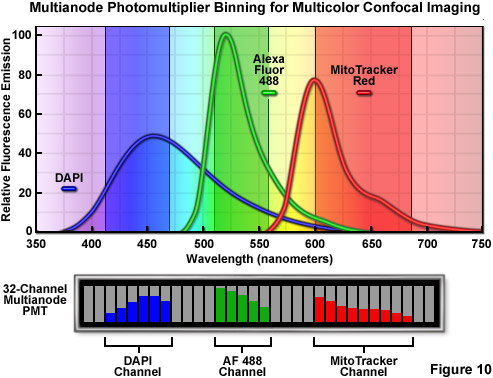
實施可變帶通檢測和激光掃描共聚焦顯微鏡提供了更大的靈活性遠遠*過傳統干涉濾光片微調的排放檢測帶寬一般成像光譜歧視的*新進展。在許多情況下,成功地分離的熒光發射阻礙了一個事實,即所選擇的熒光基團的*佳濾波器的儀器沒有配備。上面所討論的每一個光譜成像配置提供了能夠自由地配置,這使研究者設計定制的帶通設置幾乎任何熒光的檢測波長范圍。例如,使用的尼康C1si的或A1共聚焦儀,V型過濾軟件選項能夠分箱四個所選通道從一個或多個所需的發射波長范圍(參見圖10),以生成圖像。這是可以做到,無論數據是否被*終目的地進行線性分解分析。因此,現代的共聚焦顯微鏡成像光譜提供了一個顯著的優勢,為消除熒光光譜重疊在常規成像場景,還提供能力,可以輕松地創建自定義發射帶通配置他們開發新的熒光探針。
光譜圖像處理
典型的lambda棧從廣角或激光掃描共聚焦顯微鏡收購通常包含幾十萬甚至上百萬個人光譜(取決于圖像尺寸),集合中的每個像素之一。由此產生的數據集是非常大的,因此太復雜,直觀地解釋。一套全面的軟件工具是必需的光譜圖像數據的處理和顯示,這方面的需求已經解決了一些算法已發表 的文獻。此外,所有市售共聚焦顯微鏡成像光譜伴隨著*的專有軟件包專門使用儀器采集的數據進行數據分析和演示。光譜圖像的分析,可以執行基于光譜特征或存在于數據集的圖像特征(有時兩個),但大多數數學方法涉及被統稱為線性分解或線性分解算法。的lambda棧軟件分析可以應用于熒光探針的任意組合,但圖像堆棧組成的吸收染料或反射光的光譜特征,必須被轉換成光密度值,然后再應用線性分解算法。
原來的光譜圖像分析算法設計開發的主要目的是為了分配單獨簽名衛星圖像中捕獲的對象。*有用的圖像分析這一類的數學方法被稱為主成分分析(PCA),監督分類分析(SCA),多元曲線分辨(MCR),線性分解(LU)。這些算法是基于這樣的假設,所測量的信號從每一個波長(或顏色)的線性正比于該波長的試樣的百分比或濃度。這種假設通常是正確的,當吸收染料或熒光探針的濃度低,但結果明顯偏離線性的濃度達到飽和水平。在這種情況下,修正項必須被應用。要明確注意的另一個重要的一點是,每個熒光團或吸收染料具有**的光譜特征,可獨立確定用于在分配適當的貢獻從該探針或染料在lambda堆棧中的個別像素作為參考。收集準確的參考光譜是任務關鍵的一步,應仔細進行光譜圖像分析開始之前。
在一個典型的基于熒光的光譜成像實驗,通常有幾種熒光團存在于試樣中,每一個標簽不同的結構。整個在此試樣中的圖像,發現單獨或作為混合物根據其空間的分布范圍內的物鏡的細胞器或大分子的熒光團。線性分解分析的目的是從每個熒光基團的每一個像素的圖像,以確定的相對貢獻。在大多數情況下,該算法的正確使用,需要個別單獨制備的對照樣品,可用于所有的實驗中所用的熒光團的發射光譜中的記錄。對照樣品的試驗片(如安裝介質和細胞類型)使用相同的技術制備的,并必須被記錄,可使用相同的儀器設置(增益,濾波器,物鏡,激光功率等),所分析的試樣。保持嚴格控制編制樣本和記錄參考光譜的重要性不能被夸大。
線性分解的lambda棧的另一個重要標準是,所有的熒光基團分離的光譜必須是互相區分,它們也必須是線性無關的,使得沒有其他的線性組合,可以生產從光譜。這個假設是不平凡的,由于線性標準有可能會受到未知的或無意的相互作用,如熒光團之間的合作,本地化,淬火,和環境波動的能量轉移(FRET)的事實。考慮在這種情況下,一個工件,熒光共振能量轉移的供體熒光團的熒光發射強度的降低伴隨著它的頻譜稍有變化,隨著發光強度增加和潛在的受體熒光光譜蝕變可導致。然而,在任何情況下,熒光共振能量轉移的影響通常是非常小的,但應考慮成像時,有可能接受FRET的熒光探針相互作用。作為一個一般的經驗法則,線性分解軟件執行時*好使用標本表現出了很高的正在審議的所有熒光信號信噪比。
相關線性分解計算的基本概念是相對簡單的。光譜圖像中的每個像素被歸類為代表的混合物中的熒光基團信號(強度)的測量光譜(I(λ) )時,可以去卷積成的比例,重量或濃度(C)的每個單獨的熒光基團的參考光譜(? (λ) ),當值的總和。因此,每一個純粹的熒光基團的參考光譜描述作為Ri(λ),其中i = 1,2,3 ..... n表示的熒光基團(Ci)的索引。對于一個特定的熒光基團的數目(n)的,這種關系可以表示為:
I(λ) = C1?R1(λ) + C2?R2(λ) + C3?R3(λ) + ........ + Cn?Rn(λ)
或者更簡單的:
I(λ) = ∑i Ci?Ri(λ)
在實踐中,被確定為(I)的光譜圖像中的每個像素的信號強度,并記錄,可在采集過程中的已知的熒光基團的lambda棧和參考光譜的獨立測量中只有一個單一的使用相同的樣品的熒光基團標記的單獨的控制標本制備技術和儀器設置。從試樣中的各種熒光團的總光譜貢獻可以被確定為一個簡單的線性代數矩陣行使的每個點,在上述公式中所描述的測量光譜,通過計算各自的貢獻。對于許多市售的線性分解的軟件產品的,將溶液通過以下方式獲得輸入參考光譜和通過使用逆*小二乘法擬合的方法,*大限度地減少測量之間的平方差和計算的光譜。
為了確保*好的機會獲得成功的結果,應用線性分解算法時,幾個實驗條件必須得到滿足。其中一個*重要的考慮是,以確保光譜檢測信道的數目是至少等于標本中存在的熒光團的數目。如果以滿足本說明書中,可能會導致多個解決方案來計算光譜分離的和**的結果可能無法。線性分解的另一個關鍵要求是,所有標本中存在的熒光團必須在計算中考慮或結果可能會偏向占主導地位(*濃)熒光不太集中的物種的費用。具有諷刺意味的是,不會影響包括在計算不匹配任何在lambda棧熒光光譜線性分解結果(零貢獻,將被分配到缺少的熒光)。*后,自體熒光和/或高背景水平也應該被定義光譜(如果可能的話),并用作為一個額外的熒光基團,以達到*佳的結果。可選地,也可以計算的誤差項和輸出作為一個錯誤的殘差圖像。
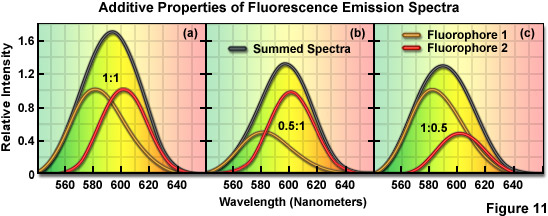
加入熒光基團光譜的線性在圖11中示出了兩種不同的混合物,但高度假設的熒光基團,具有發射*大值居住在橙黃色(熒光基團1)和橙紅色(熒光團2)光譜區域重疊。在圖11中的黑色曲線(a)至圖11(c)表示的求和的兩個熒光基團在不同濃度的光譜:圖11(a)一個為1;圖11(b)0.5?1,以及圖11(三)為1?0.5。雖然在圖11中的光譜給出代表只有3個熒光基團的組合的例子,可以很容易地進行預測的總和的頻譜為每一種可能的組合,這兩個熒光基團僅僅通過增加強度作為濃度的函數。需要注意的是峰的總和的光譜的變化的比例的成分的熒光基團,例如,*大為594毫微米,在圖11(a)中在圖11(b)中的598納米,589納米(三)在圖11中。應該強調的是線性分解利用整個光譜曲線(次),不只是峰值位置。**的算法,如那些用于光譜核型分析和共聚焦顯微鏡,還可以處理復雜的曲線分析和糾正分鐘的光譜移動。
兩個熒光基團,類似于在圖11中的標記的檢體分析的頻譜內容時,*簡單的方法是從任何特定的像素之和與所有可能的組合,居住在光譜的參考圖書館的總和的頻譜相匹配。作為一個例子,如果測得的求和頻譜的黑色曲線,在圖11(a)是一個非常接近的比賽,它表示的像素包含從各熒光團50%的貢獻,它們均勻混合,在檢體(至少在該象素)。同樣,如果在圖11(b)的總和的頻譜相匹配的黑色曲線,可以假定,該像素包含66%的熒光基團和33%的熒光基團1。因此,它可以被歸納,通過比較代表的總和的測量光譜與參考圖像中的預測的光譜庫軟件應用的*佳擬合參數的矩陣的線性分解操作。一旦已經確定時,每個熒光的光譜貢獻的lambda棧可以被分隔成單個圖像的每個熒光基團,如在圖12中示出。
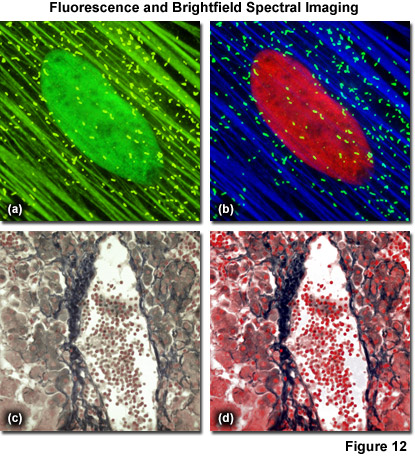
圖12(a)和12(b)是一對的光譜混合和未混合的圖像,分別貼壁培養的數生長期印度麂鹿皮膚成纖維細胞,它們被固定在聚甲醛和標有:綠色SYTOX(細胞核)的Alexa Fluor 488標記的鬼筆環肽(絲狀肌動蛋白)的Alexa Fluor 514標記的山羊二次抗體針對兔小學PMP-70抗體,過氧化物酶體膜蛋白(過氧化物酶)。一個尼康C1si的共聚焦顯微鏡使用了2.5毫米衍射光柵耦合激發使用488納米氬離子激光器(圖12(a))470至550納米的波長范圍內使用收集排放。拉姆達堆疊的線性未混合和pseudocolored的,(細胞核,紅色),(肌動蛋白,藍色),過氧化物酶體(綠色),以產生*終的圖像,如圖12(b)中所示。在圖12(c)和圖12(d)所示的明場圖像獲取使用一個固定的人肝組織標本與曙紅和蘇木精染色。一個尼康80I顯微鏡配備一個量子色動力學(古奇和HOUSEGO的)恒指高光譜成像探測器和安道爾IXON EMCCD用來捕捉一個明場圖像的混合試樣(圖12(c)條)。線性分解后,更清楚地辨別兩種染料標記的檢體的特定區域(圖圖12(d)),通過將假色。
雖然光譜成像和線性分解成為一個重要的工具,用于分析復雜的混合物頻譜重疊的激光掃描共聚焦顯微鏡的熒光探針,這種技術也越來越多地被應用到病理組織和細胞吸收染料染色標本上進行的測量和成像使用傳統明視場顯微鏡。為了吸收染料進行線性分解分析,可以使用類似的算法已被過濾后的數據以補償因素,適用于吸收而不是發射光譜。在熒光測量相比,明場分析技術要求的吸收收集的數據對每一個像素的光譜的光源光透過樣品的檔案必須分開。透射光照明效果,必須測量作為一個額外的參考。合成染料的吸收光譜是線性依賴于濃度(比爾 - 朗伯定律所決定的)。在數學上,吸收染料的線性的不混溶的計算是使用熒光探針的那些相似,并可以由下面的公式表示:
A(λ) = ∑i εi(λ) ? Ci ? Li
比爾-朗伯方程所決定的,甲染料物種的吸光度(一) , C 是濃度,以及L是試樣的光程長,這通常是在微米染色的組織內的測量。執行計算之前,必須測定的光密度,為每個傳輸的測量值的吸收的植物種。應當指出的光密度轉換的發送數據中的引入顯著的噪聲電平可能會導致信號電平低時,為特定的吸光物質,因而復雜的解混結果。在這種情況下,*好是進行頻譜分析通過僅包括峰值附近的吸收區域。類似的線性分解熒光探針的情況下,為每個污垢在試樣中的濃度可以在圖像中的每個像素進行計算,如果合適的參考吸收光譜已被被獨立地確定。
熒光模式進行比較明場吸 收染料光譜成像,吸收染料標本通常不隨時間而褪色,而檢查熒光標本非常行為可導致漂白。吸收染料染色的標本通常具有小于2.0的光密度(OD)為單位的動態范圍為0.05 ,0.05 OD是很難區分背景,對應于約1%的透光性,這是相對較暗的2.0光密度單位。吸收圖像也聚光鏡數值孔徑光闌由于眩光分配錯誤,如果沒有正確調整。此外,吸收染料成像還需要整個成像系統的透徹理解。例如,如果由一個標準的鎢鹵燈發出的近紅外光(熱)沒有被阻塞(實際上,波長大于720納米),可以檢測由CCD攝像系統,并添加到作為噪聲的強度計數。在理想的情況下,一個寬的帶通濾波器以除去不需要的波長的光路應包括在紫外線和近紅外線的阻斷。進一步吸收染料成像范圍內的一個事實,即*大曝光時間必須小于飽和所需的檢測器。與此相反,熒光曝光時間通常是有限由檢測器的熱噪聲。
光譜成像應用
光譜成像提供了必要的基礎和工具,以調查在各種各樣的應用,包括活細胞成像,核型分析,常規熒光成像,藥物研發,檢測分子間的相互作用,組織病理現象。分子正在調查收集部分或完整的光譜信息的能力使混合熒光和吸收染料的檢測和鑒別,即使在探頭的情況下,表現出類似的顏色和高度重疊的光譜剖面。這種**的技術允許調查標記多種細胞和組織的物鏡,保證通過出血和明顯的合作定位不會干擾在圖像分析。此外,加上線性分解光譜成像所提供的信息可用于區分合法信號和工件產生的固色劑,轉染試劑,安裝中折射率波動。光譜成像也成為消除自發熒光和監測動態分子間的相互作用所產生的共振能量轉移的一種重要方法。
光譜核型分析,熒光原位雜交技術的基礎上,光譜成像*流行 的應用之一,已經看到了廣泛的接受。在一個典型的實驗中,使用多達五種不同的熒光團來標記每個的24人染色體,該技術也可以適用于來自其他物種的染色體。每個染色體被標記為不同的熒光基團的組合,如Cy5標記,FITC,若丹明,的Alexa Fluor染料,或者任何的ATTO染料的。組合標記結果在2 N - 1種可能的組合。因此,使用庫存總量只有5個熒光團產生31個可能的染料組合,可以很容易地辨別與分析軟件(參見圖13(a))。在分析過程中,圖像掃描波長,分割的空間分布,則每個像素的分類的基礎上的五個熒光光譜和每個染色體的公知的熒光基團的組合的表的參考圖書館。分類分析的結果,一般在將顯示在單獨的顏色,每個顏色表示不同的染色體上(如圖圖13(b)中示出)。所獲取的光譜數據的高特異性,使一個成功的分類在大多數染色體制劑,即使在使用復雜的組織切片。通過增加第六染料偶聯物探針針對特定地區,或所有染色體短臂探針,獲得額外的信息可以自動核型分析。在實踐中,往往是結合光譜核型分析用DAPI綁扎。
中遇到的復雜的信號FRET顯微鏡由過量的所要求的熒光基團,以便進行共振能量轉移光譜重疊所混淆。因此,在除了分開多色固定和活細胞中的熒光光譜的光譜成像的能力,該技術是*適合解開供體和受體熒光團的發射的貢獻FRET成像。FRET分析由于其高圖像捕獲率,這往往是必要的,當調查毫秒級的時間尺度上進行操作的熒光蛋白的生物傳感器,特別適合用于現代高性能共聚焦顯微鏡,配備多陽極探測器。32通道多陽極探測器,光譜成像的共聚焦顯微鏡,可以獲取整個光譜響應來自FRET熒光團在單次掃描。不過,即使光譜成像是能夠同時檢測兩個熒光團的發射信號的FRET,該技術是不能區分通過能量轉移產生的受體發射信號來源于直接激發。因此,適當控制使用供體和受體蛋白分別表示有必要進行定量分析。在光譜成像是用來評估FRET熒光蛋白表達的生物傳感器作為一個單一的多肽的情況下,控制是不那么重要。
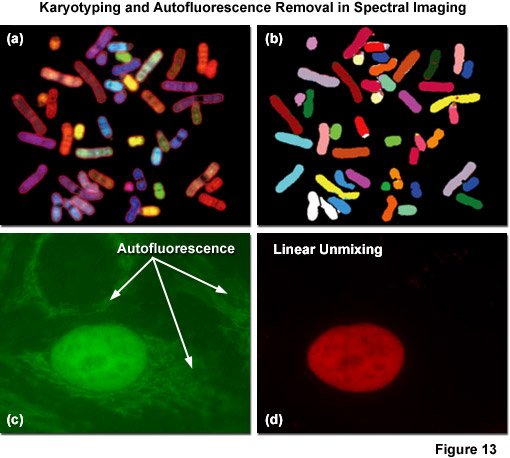
其中*關鍵的工件,導致在活細胞成像信號 - 噪聲的減少是自體熒光,來自若干來源,包括自然熒光的生物分子(如NADH,核黃素,和彈性),DNA轉染試劑,文化傳媒,和外源性藥物(藥物和生化)的成像介質。成像時,細胞和組織已準備與多聚甲醛固色劑誘導的自體熒光也特別問題,神器可以干擾全身顯像在特定的組織(大腦和皮膚)。此外,植物組織在整個可見光譜區域,趨于表現出高度的內在的自體熒光。光譜成像的***的應用程序之一是消除自發熒光標記標本弱發射熒光團或那些稀疏定位的。在大多數情況下,自發熒光可以作為一個單獨的熒光基團具有不同的光譜輪廓(在對照樣品中*容易地確定),可以從感興趣的信號,未混合的處理,因此可以減少或完全消除從*終的圖像(參見圖13 (c)和13條(d))。重要的是要注意減少自發熒光的水平在更長的波長在活細胞成像,所以慎重選擇發射的橙色和紅色區域的熒光團可以幫助減少這種神器。
多吸收染料染色的標本進行病理檢查,在光照下成像光譜成像和廣角鏡線性分解*的候選人。許多常見的合成吸收污漬和染料用于染色細胞涂片和組織切片具有復雜的光譜重疊,具有顯著的水平。然而,在明場成像的信號通常是強,漂白是*小的或不存在的。光譜成像可以使用標有幾種染料產生單獨的圖像,目前標本只有一個單一的染料染色時會出現與明標本。然后,可以進行后處理,以確定于特定結構的染料的共定位。光譜成像的明標本中遇到的*嚴重的文物發生,當成像染料,含有沉淀物,而不是吸收散射光或時細胞和組織overstained的。
光譜成像的實踐意義
光譜成像技術和線性分解實驗協議的情況下,優化利用儀器的功能和軟件參數,確保不會無意中介紹危及文物的潛力,取得優異的成績。總之,大多數光譜成像實驗的成敗往往取決于研究者的控制下的變量。*重要的方面是(關鍵任務),以獲得準確的參考光譜控制熒光樣品,忠實地代表真正的光譜。此外,必須采取非常謹慎,以確保控制和測試試樣相同的條件下制備熒光濃度方面,文化傳媒,固色劑,洗緩沖區,安裝媒體,光學質量的玻璃載玻片和蓋玻片。儀器參數也應該是相同的控制,并根據調查的樣本。這些措施包括使用相同的物鏡,浸油,激光電源,光電倍增管的設置,針孔的直徑,二色鏡,波長掃描范圍,像素停留時間。在理想條件下,其中的熒光基團的空間分布的許可證,可以獲取參考圖像中的試驗片的非重疊區域。
即使*的線性分解算法能夠解決光譜的熒光基團,具有一個顯著的重疊程度,在大多數軟件產品的能力區分具有幾乎疊加的光譜的熒光基團的限制。這種現象是一種罕見的發生,通常僅見于密切相關的熒光蛋白質和合成色素衍生物。例如,氧雜蒽衍生物的Alexa Fluor 488和熒光素都具有類似取代基的主要區別在于,前者是磺化的,以增加溶解度。這兩個熒光基團的譜峰是僅由一個單一的納米分離的排放曲線幾乎是完全重疊。因此,它是無法區分的Alexa Fluor 488和熒光光譜成像和線性分解。但是,請記住,這是一個不尋常的情況下,用于標記細胞和組織的*常見的熒光基團,可以很容易地使用這個**的技術解決。
盡可能接近匹配的熒光濃度和/或控制和測試標本的熒光蛋白的表達水平,將有助于確保令人滿意的結果光譜成像。在一般情況下,研究者應努力盡可能達到*高的信號噪聲水平。由于光譜成像儀器的各個通道上的范圍從約2到10納米的帶寬,儀器的靈敏度總是有限的能寄存器,每個波長帶中的檢測器的光子的數量。因此,可接受的光譜分辨率為5納米或以下的熒光團分離時,才有可能使用明亮的熒光標記標本。不幸的是,在非常高的分辨率(5納米以下),典型的生物標本往往表現出標有熒光基團,是非常暗淡或有稀疏定位時的噪聲信號和圖像質量不佳。因此,*佳的線性分解的結果,得到時,檢測信道的寬度盡可能大。
在其他光譜成像實驗關注的背景水平高,過多的探測器和光學系統的噪聲,以及自發熒光。高背景發生不正確的有針對性的熒光團,overstaining,激光線的噪音,安裝媒體的不均勻性,浸油不匹配,雜散光,以及自發熒光。在大多數情況下,背景水平相減技術,可減少使用后的頻譜數據收集。檢測器和光噪聲成為問題的成像時,弱熒光探針,但通常可以通過檢測信道的數量減少和更大帶寬的掃描有效地消除。自體熒光是*好的處理,包括它作為一個單獨的熒光通道線性分解過程中有一個**的光譜剖面。總之,仔細注意儀器配置的詳細信息,樣品制備技術,以及選擇*佳熒光光譜成像實驗的成功結果的關鍵。



