奧林巴斯顯微鏡:光學熒光筆熒光蛋白
熒光蛋白的發現和后續優化中的遺傳性質的這些顯著的探針來生成各種各樣的發射帶寬配置已擴展生物學家在活細胞中具有高時空分辨率的可視化,跟蹤和量化分子事件的能力。熒光蛋白可以融合到幾乎任何感興趣的蛋白質或酶,礁珊瑚,水母和海葵物種的各種來自以分析在活細胞中蛋白質地理,運動,血統,和生物化學。在此方面,這些生物探針提供了一個重要的新的方法來了解蛋白質的功能,這是一個合乎邏輯的步驟細胞過程的調查,現在許多生物體的基因組序列已被確定。
然而,由于已被用作熒光蛋白的亞細胞目標和在活細胞中的基因產物的功能特性進行調查,許多設計的應用程序,以確定蛋白的周轉率或時間的表達模式的分析幾乎是不可能的,由于與傳統的熒光蛋白的事實,即它們連續地被回收(合成,折疊,和隨后的退化)在細胞內的。其結果是,一個大合奏的蛋白質在其一生中的不同階段被觀察在任何特定時刻與傳統的熒光蛋白,表現出穩定的發射光譜的檔案。
表征蛋白質表達時間或終身的一個簡單的方法是利用不穩定的熒光蛋白的變種,可以很容易地通過熒光強度區分。因此,嵌合熒光蛋白是通過蛋白水解迅速上交可劃分為類較年輕的,新合成的熒光分子,已經失去了他們的發色基團的降解,由于熒光的老蛋白嵌合體。不幸的是,迅速衰減的熒光結果在非常低的信號水平,呈現準確地監測蛋白質動力學,并獲得合適的數字圖像之間的一種折衷。
一個更有效的解決方案是采用熒光蛋白的光譜特性隨時間的變化,光照波長或類似的研究者可以控制的變量。這個類中進行探測的*和*基本的例子之一是產生的隨機誘變的紅色發光的珊瑚礁來自Discosoma芨(*指定作為突變drFP583,但現在通常被稱為熒光蛋白的熒光計時器蛋白DsRed的)。*初,定時器蛋白產生的綠色發光的熒光基團(峰值在500納米,類似于綠色熒光蛋白),但*過幾個小時內,慢慢地轉換的熒光,在黃-紅光譜區域發射一個物種(和*多在580納米)。與定時器部分的嵌合融合蛋白的前進年齡可確定由持續下降,所觀察到的比綠色到紅色熒光。然后,這個比率可以被用來收集用于基因表達的時空數據調查。
代表也許是*有前途的方法,可以激活從靜止狀態(這個過程被稱為光活化),或啟動熒光蛋白生色能夠被光轉換熒光發射帶寬從一個到另一個(光電轉換),體內蛋白質的壽命,運輸和周轉率的調查。適當稱為分子或光熒光筆,一般很少或根本沒有顯示的光活化熒光蛋白成像波長的激發下初始熒光,但顯著提高其熒光強度照射激活后,在不同的波長(通常較低)。光轉化光學熒光筆,另一方面,經過時光學變化的生色團的熒光發射帶寬配置的變化。這些影響導致的直接和受控的高亮顯示的不同的分子在細胞內池。因為只有有限人口的光敏分子表現出明顯的熒光,其壽命和行為獨立的新合成的蛋白質,可以遵循。在類似的方式中,熒光蛋白,其能夠是光調制的光轉化通過可逆地改變發光強度和/或顏色也可能是非常有用的研究在活細胞中的動態過程。
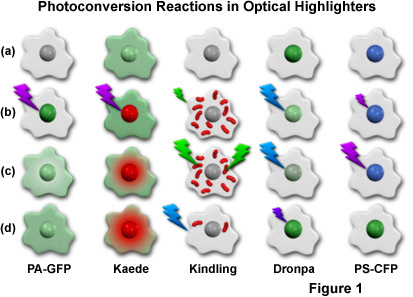
圖1中顯示出一個卡通發展到今天為止(在下面更詳細討論)是*有用的光學熒光筆光轉化的機制。激活或轉換序列為每個熒光筆在單個列概述,較單個細胞含有一個中央核序列中的每一步都被雇用重復卡通繪圖。高強度的照明大閃電,而低強度照明為代表的小螺栓。的熒光的激發波長是閃電的顏色相似,而發光顏色出現在細胞核和/或細胞質中的細胞動畫片。要檢查的順序,*上面畫的細胞開始,并繼續向下列。例如,一個單一的單元格包含光活化的綠色熒光蛋白(PA-GFP ;下面描述)示出轉換前的*列的頂部,并且非熒光顯示(灰度)。(三)光照后的405納米的光(紫色閃電,圖1(b))中的核,具有綠色熒光,慢慢地擴散到細胞質中,所示的較低的兩個細胞動畫片(PA-GFP蛋白的及(d)),在*列中。其它列包含序列象征光學熒光筆在隨后的章節中討論的光轉化機制。
發現光熒光筆
早期的努力產生一個有用的光可活化熒光蛋白會見了相對溫和的成功。光學熒光筆*調查集中在野生型綠色熒光蛋白(GFP),來自水母Aequorea victoria的,主要在395至400納米為中心的和*多的紫外光譜區的吸收。成離子酚物種吸收強烈,*高在483納米,400納米區域中的蛋白質與紫色光照明將中性酚醛生色。光轉化反應介導的谷氨酸殘基的熒光蛋白質主鏈中的位置222中的脫羧作用。經過激烈的紫光燈照射,可激發產生的綠色熒光,在395和488納米的相對強度監測,跟蹤光活化的野生型GFP,盡管有一些限制。首先,雖然定量的原則,的雙重激勵技術,不容易使用大多數激光掃描共聚焦顯微鏡進行。第二個缺點是光活化的野生型綠色熒光蛋白只產生熒光信號強度增加了三倍。*后,使用近紫外光激發損害*活細胞(尤其是照射時,核區),并在圖像采集過程持續光敏引發了一個問題。
的綠色熒光蛋白在厭氧條件下,以一個物種,發射橙紅色區域的波長(590-600納米)的光轉化是潛在有用的,在低的氧環境中的細菌和酵母的調查,但在培養的哺乳動物的研究中提供的小工具細胞。從綠色到紅色的熒光發射的過渡時,會發生氧不足型綠色熒光蛋白(分離或內完好生物體)與藍色的電弧放電燈或激光源的光的相對低劑量的照射。用紫外光光激活的綠色熒光蛋白,綠色熒光蛋白在缺氧的情況下所產生的藍色照明的紅色熒光強度相對較低。此外,效果減弱后迅速返回到正常有氧條件。
光學熒光筆的屬性
| 熒光 蛋白 (縮寫色) | 勵磁 *大 (NM) | 排放 *大 (NM) | 摩爾 消光 系數 | 量子 產量 | 在體內的 分子 結構 | 相對 亮度 (EGFP%) | pKa值 |
|---|---|---|---|---|---|---|---|
| PA-GFP(G / NA) | 400 | 515 | 20,700 | 0.13 | 單體 | 8 | 4.5 |
| PA-GFP(G) | 504 | 517 | 17,400 | 0.79 | 單體 | 41 | - |
| PS-CFP(C) | 402 | 468 | 34,000 | 0.16 | 單體 | 16 | 4.0 |
| PS-CFP(G) | 490 | 511 | 27,000 | 0.19 | 單體 | 15 | 6 |
| PS-CFP2(C) | 400 | 468 | 43,000 | 0.20 | 單體 | 26 | 4.3 |
| PS-CFP2(G) | 490 | 511 | 47,000 | 0.23 | 單體 | 32 | 6.1 |
| PA-mRFP1(R) | 578 | 605 | 10,000 | 0.08 | 單體 | 3 | 4.4 |
| Kaede(G) | 508 | 518 | 98,800 | 0.88 | 四聚體 | 259 | 5.6 |
| Kaede(R) | 572 | 580 | 60,400 | 0.33 | 四聚體 | 59 | 5.6 |
| Kikume(KikGR D&G) | 507 | 517 | 53,700 | 0.70 | 四聚體 | 112 | 7.8 |
| Kikume(KikGR R) | 583 | 593 | 35,100 | 0.65 | 四聚體 | 68 | 5.5 |
| wtEosFP(G) | 506 | 516 | 72,000 | 0.70 | 四聚體 | 150 | - |
| wtEosFP(R) | 571 | 581 | 41,000 | 0.55 | 四聚體 | 67 | - |
| dEosFP(G) | 506 | 516 | 84,000 | 0.66 | 二聚體 | 165 | - |
| dEosFP(R) | 569 | 581 | 33,000 | 0.60 | 二聚體 | 59 | - |
| tdEosFP(G) | 506 | 516 | 84,000 | 0.66 | 單體 | 165 | - |
| tdEosFP(R) | 569 | 581 | 33,000 | 0.60 | 單體 | 59 | - |
| mEosFP(G) | 505 | 516 | 67,200 | 0.64 | 單體 | 128 | 5.5 |
| mEosFP(R) | 569 | 581 | 37,000 | 0.62 | 單體 | 68 | 5.5 |
| Dendra(G) | 488 | 505 | 21,000 | 0.70 | 單體 | 44 | 6.6 |
| Dendra(R) | 556 | 575 | 20,000 | 0.72 | 單體 | 43 | 6.9 |
| Dendra2(G) | 490 | 507 | 45,000 | 0.50 | 單體 | 67 | 6.6 |
| Dendra2(R) | 553 | 573 | 35,000 | 0.55 | 單體 | 57 | 6.9 |
| Kindling(R) | 580 | 600 | 59,000 | 0.07 | 四聚體 | 12 | - |
| Dronpa(G) | 503 | 518 | 95,000 | 0.85 | 單體 | 240 | 5.0 |
表1
旨在探討使用紅色熒光蛋白和一些衍生工具,多光子成像光學熒光筆在實驗過程中,調查人員發現,暴露在波長小于760納米的飛秒脈沖激光照射轉移珊瑚礁從紅色到綠色熒光蛋白的發光顏色。這種過渡的機制被認為是鏈接到內發生的蛋白質的四聚體,由于從成熟形式的蛋白質的紅色發射光漂白的熒光共振能量轉移(FRET)的減少,從而提高綠色發射,從不成熟的物種。簡稱為綠化的效果,這種現象似乎很復雜依賴于成熟DsRed的效率。多光子激發的一個優點是專門DsRed的體積內選定的區域(體素)的光轉化本地化的能力,但該方法需要專業和昂貴的設備(飛秒鈦藍寶石激光),許多實驗室提供。此外,珊瑚礁的蛋白質(包括紅色熒光蛋白)的傾向預留形成的四聚體在體內常常會影響這些探針的能力,參與生物功能的嵌合體的形成。
在漂白后熒光恢復(FRAP)和熒光漂白損失(FLIP),目標選擇性地漂白熄滅從一個熒光基團的熒光作為一個參考標簽,同時使其他的兩個不同的熒光蛋白融合的嵌合蛋白質有關的技術。稱為熒光漂白后(FLAP)的本地化,方法是由于它能夠選擇性地跟蹤熔融嵌合熒光蛋白在活細胞中的光敏相媲美。使用β -肌動蛋白的融合構建具有增強的黃色和青色熒光蛋白,同時跟蹤貼壁的成纖維細胞中的快速重定位動態的單體(球狀)G-肌動蛋白和絲狀F-肌動蛋白的慢得多的動態進行了試驗性研究。這種技術有望用于許多應用中,但需要幾乎相同的表達水平在共轉染的細胞中,各嵌合體的缺點是可能會復雜生物復雜的調查。
上面描述的方法可以成功地應用在某些情況下,蛋白質利用熒光蛋白跟蹤和動態調查。然而,每種技術具有很大的局限性,妨礙了它的廣泛應用監測許多活細胞中的處理所必需的基本研究。具體來說,這些光學熒光筆限制其惡劣的熒光強度和不穩定的光轉換產品。進一步的限制,簡單,高效,和具體的照明技術,光轉化的蛋白質無法強制執行。
了理想的光學熒光筆蛋白應該是容易地photoconvertible(通過熒光激活和/或發射波長位移的過程中)產生一個高的對比度水平,以及在目標系統中的*佳表達的單體。在實驗中得到的結果與光漂白技術,如光漂白恢復(FRAP)和損失(FLIP)并聯,這些探針將是特別有用的,因為它們有優點,測量不影響新合成的或未轉化的蛋白質,它或者是不可見的,或繼續排放原來的波長。另外,通過在感興趣的區域中的反復激發,光學熒光筆可以連續光轉換在一個特定的細胞內定位。這種技術是比翻蓋更高效,因為,活化蛋白易位可以直接成像。此外,光活化所需要的時間(幾秒鐘)常常是遠小于所需要的時間完全光漂白的類似區域。從改善時間分辨率,調查涉及極其迅速的蜂窩進程將明顯受益。
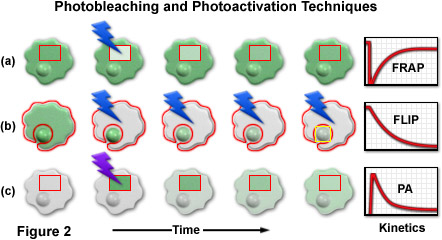
一系列的卡通圖(示出典型的細胞的細胞核和細胞質),*常見的光漂白和光活化技術進行比較,如圖2中所示。漂白劑和活化的區域用紅色邊界概述和,閃電代表光學漂白或光敏事件。標記為紅色的區域也被用于進行定量分析的動力學參數繪制在圖中的右手側上的圖形。在一個典型的FRAP實驗(圖圖2(a)),具有高強度的脈沖串的藍色光的光漂白的熒光分子的選定區域的矩形框的內部被照亮。漂白后的事件,新的蛋白質緩慢擴散到該區域,恢復細胞的熒光強度返回到穩定狀態(繪制在圖形)。FLIP,在圖2(b)所示,是類似的FRAP除外,整個單元格的內容被重復的一個小的感興趣區域(在此示例中,核)與異常光漂白。作為漂白周期進展,熒光蛋白在細胞核中擴散到細胞質中,在那里,其后漂白。光敏(圖2(C)),所選區域與高強度的紫外光照射誘導熒光光學螢光蛋白質。作為光活化光的熒光筆擴散通過細胞質和細胞核的熒光強度降低選擇邊界內。一個相關的技術,稱為逆熒光漂白后恢復(iFRAP,圖中未示出)產生的結果類似的光活化,但需要漂白所選區域之外的整個蜂窩內容。
示于表1熒光蛋白在體內的探針,針對細胞結構和功能的應用程序中顯示顯著的潛在的重要數據的匯編。包括的激勵(或吸收)和*大熒光發射波長為激活的和未激活的物種,以及的摩爾消光系數,量子產率,分子結構(單體,二聚體,四聚體等),和相對亮度增強型綠色熒光蛋白(EGFP)的水平相比。還列出了所報告的pKa值,它揭示了用于光學熒光筆蛋白在酸性環境中的發射光譜的比較穩定的。此表應作為一個方便的指南比較光學熒光筆的屬性。
光活化的綠色熒光蛋白(PA-GFP)
*個有用的光學熒光筆專為光敏研究水母Aequorea victoria的綠色熒光蛋白,稱為PA-GFP(使用縮寫,以創建一個從照片和激活的縮寫)的一個變種。這種光可激活的版本開發的GFP中性為主的形式從一個物種,是陰離子性質的天然野生型蛋白生色團的光轉換效率提高。位點定向突變的主要目標是一個單一的氨基酸殘基,位于第203位的蘇氨酸,在野生型的發色團,它可以被修改任一項幾個氨基酸的取代,以減少在475納米的初始吸光度同時仍然允許光敏。特別是,這組氨酸殘基(PA-GFP的變體)的結果在一個戲劇性的消光系數增加的吸收光譜輪廓中的藍青色區域(在504納米為中心)蛋白被激活時,通過用紫外線照射被突變或紫色光,在360和420納米之間的范圍內。
在無擾狀態中,野生型綠色熒光蛋白發色團的中性酚和陰離子酚鹽(如上面所述),共同產生的到雙峰的主要和次要的*大吸收值在395和475納米,分別包含一個混合的人口。這些峰的大小比為六比一。但是,當蛋白質與高強度的紫外或紫色光照射時,發色基團人口進行光電轉換和移位為主的陰離子形式,扭轉的主要和次要吸收峰的相對消光系數比為。其結果是在488納米激發時的發色基團的熒光信號強度增加約3倍。PA-GFP的是專門設計的意圖的同時增強與野生型的根據紫照度(約400納米)的光轉換效率的降低輕微的吸收峰在475納米。203位的組氨酸殘基替換450和550納米之間的區域中,具有可忽略的吸收所產生的一個變種來滿足這一要求,因此大大地提高了非激活和激活物種之間的對比度。
與紫光光活化后,在PA-GFP的*大吸收波長為504納米的增加約100倍。此事件喚起PA-GFP的轉換和尚未轉換池的非常高的對比度差異,用于分子內的細胞的亞群(參見圖1中的序列)的動態跟蹤。請注意,光活化后,于PA-GFP和野生型GFP的熒光時,用488納米的激光照射表現出可比的水平。不利的一面,PA-GFP表達細胞內的目標是不容易辨別出來的光轉化之前沒有使用低強度紫照明源(如405納米的藍色激光二極管),使得難以識別出正確的區域有選擇地針對光敏實驗用顯微鏡具有藍色和綠色激光器。此外,光學標記和未標記的蛋白質之間的相互作用,不能很容易地在這些共焦顯微鏡觀察。
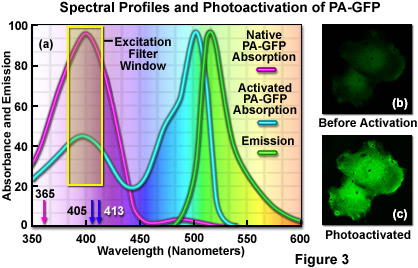
在實際應用中,光活化和成像的要求是主要的問題時,使用PA-GFP的突出分子事件。蛋白被激活后,PA-GFP的激發和發射*大值被轉移至較長的波長相比,EGFP由幾納米,但類似的過濾器集應該是有用的兩個探頭(參見圖3(a))。可以忽略不計的PA-GFP的熒光發射的光活化之前是可以克服的含有分子,使用在360至420納米范圍內的低水平的照明,由成像目標。這些帶寬可以實現在寬視場顯微鏡使用紫色激發濾光片,以及近紫外和紫色激光共聚焦工具。將所得的本機PA-GFP綠色熒光非常暗,但通常是足夠的定位陽性細胞和結構(圖3(b))。請注意,必須注意盡量減少曝光時間,以避免過早的光活化的初步觀察期間(從而減少成像實驗中的對比度)。或者,具有穩定的青色量或紅色熒光蛋白載體的共轉染可用于定位窩藏PA-GFP探針的細胞。
示于圖3(a)中為PA-GFP的吸收光譜和發射光譜,在光活化之前和之后。此外,圖中所描述的激光波長(箭頭)和寬視場的電弧放電燈的激發窗口(黃色盒子),利用光敏化蛋白質。在圖3(a)中的排放量中觀察照明活化蛋白后,用488納米的激光系統。可以實現在低功率(圖3(b))與405納米二極管激光器激發的蛋白質定位目標區域。光活化后(圖圖3(c)),在可見光譜的綠色區域的熒光發射強度顯著增加。
PA-GFP的光活化的可迅速標記分子(或整個細胞),然后可以在寬視場和共聚焦顯微鏡的圖像序列與時間推移的動力學特性監測選定的人口。因為光毒性,由于在近紫外線和紫色波長照射可阻礙了一些調查,在780至840納米的多光子激發的應該是一個有益的選擇,如果必要的設備。在理想的條件下,只有光敏PA-GFP分子表現出明顯的熒光,消除任何關注新合成的蛋白質將成為熒光燈和傳統的漂白方法研究蛋白質動力學妥協的實驗時,首要關注的神器。此外,PA-GFP的光活化能產生突出顯示蛋白質的人口更迅速,有選擇性地增強型綠色熒光蛋白分子類似的人口外光漂白具有更大的光學增強。快速而可觀的光學增強,因此,通過使用PA-GFP的光活化呈現這種技術特別適合用于活細胞內蛋白質動力學分析。
*的基因工程的策略已被應用于開發新的光活化的變體的使用單體紅移礁珊瑚的熒光蛋白的位點定向誘變獲得。的單體衍生物的紅色熒光蛋白的熒光蛋白,mRFP1,特別是,已被轉換為綠色或紫外光的照射下,光活化的探針。這些被統稱PA-mRFP1s的,其中*明亮的380和400納米之間的波長激活后具有熒光強度增加70倍。光可活化蛋白生產與珊瑚礁變種出現的關鍵分子決定性殘留氨基酸持倉量146,161,197(紅色熒光蛋白編碼方案)。這些殘留物,閃中的發色基團的接近,無論是順式或反式(熒光)(非熒光)的配置,以形成熒光蛋白(順式)或色蛋白(反,可以發揮穩定的66位的酪氨酸殘基)吸收光線,但不會發出熒光。
三個氨基酸定點突變成變種能夠通過光致順反開關調節異構狀態是建立在這個類中的光可活化熒光蛋白的基本機制。單體紅色熒光蛋白光熒光筆已被證實,在哺乳動物系統中,細胞內的動態調查作為融合標簽在某些情況下是有用的。然而,相對低的水平的的PA-mRFP1s中的光活化的形式(3%的EGFP),以及與天然寡聚蛋白(例如,肌動蛋白和微管蛋白)融合時,易于形成非特異性聚集的熒光,使這些探頭比PA-GFP活細胞調查用處不大。改進單體的黃色,橙色和紅色熒光蛋白(如mCherry,mStrawberry mPlum的的)持有的電位以產生高效率的光活化的光熒光筆與發射波長在可見光光譜的紅色部分,進深延伸。
其他僧帽水母光學熒光筆
幾個可能有用的光學熒光筆探頭已被來自aceGFP,*高效的綠色熒光變種無色水母,天藍蛋白被稱為acGFPL的。隨機誘變野生型acGFPL的已產生了一些綠色熒光蛋白衍生物,其中突變,進化不變的谷氨酸殘基的多肽主鏈中的位置222代替甘氨酸。已表現出*高水平的綠色熒光發射的衍生物名為aceGFP的區分其來源,從蛋白質中的A。維多利亞家庭。除了 潛在效用aceGFP類似EGFP作為一個有用的生物工具,222位的谷氨酸的重新引入這轉換成無色的蛋白(aceGFP-G222E)的衍生物,與潛在作為光活化熒光筆的。
的吸收光譜的檔案aceGFP-G222E設有具有高的消光系數在280納米和第二峰值在390納米,小的和*多。在250和300納米的外觀,結果在一個新的具有*大的吸收曲線在480納米之間的范圍內的蛋白質用紫外光照射。由于這種轉變不伴有藍色吸收減少390納米峰值消光系數,研究者們推測,轉換源于不成熟,光譜檢測不到的物種。在488納米激發的光活化aceGFP的G222E產生綠色熒光,*大發射波長在505納米和高的量子產率(0.45),產生一個近似的1000倍的熒光強度增加。
不幸的是,相當的光學和生物光敏aceGFP-G222E(波長300納米以下的紫外線)的要求排除這種探頭的廣泛使用,由于活細胞成像實驗,部分潛在的破壞性的輻射效應。此外,大多數顯微鏡不低于360納米的波長區域中,可以有效地透射光的光學列車。扣除明顯的電流限制,光轉化成蛋白質吸收光線中的藍色光譜區域不成熟的物種從無色的aceGFP-G222E是一種新的現象,那肯定值得進一步調查。額外的修改和相關蛋白從多管水母可提供類似的屬性,以PA-GFP的光熒光筆一類新的。
另一種新穎的光轉化光熒光筆,被稱為光開關的青色熒光蛋白(PS-CFP),來自水母coerulescens綠色熒光蛋白變體,aceGFP,已觀察到在405納米(如第5列中所示的照明時,轉換從青色到綠色熒光圖1)。對PS-CFP熒光筆所產生的位點定向誘變aceGFP。作為單體的表達在生物體內時,該探頭應是有用的,在光漂白,光轉化,和光活化的調查,因為它可能被融合到各種各樣的蛋白質,而不改變他們的行為。PS-CFP的另一個優勢是顯著的水平,是目前光電轉換前,允許調查人員追蹤和選擇性照亮細胞內特定的區域或整個細胞研究的一個因素,青色熒光。然而,從PS-CFP的熒光發射強度比PA-GFP的約2.5倍的調光器,并且,該探頭是不如其他方面的光電轉換效率(熒光筆熒光發射的光轉化的40納米的波長偏移小于觀察類似光學熒光筆)。
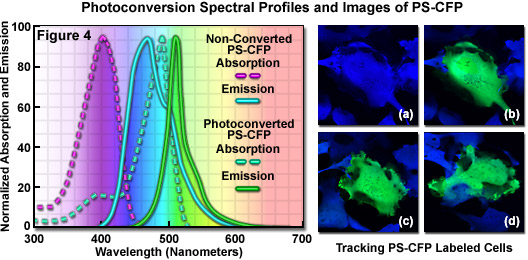
呈現在圖4的左手側的光電轉換之前和之后的PS-CFP的吸收和熒光發射光譜。由虛線表示本機和光轉換PS-CFP蛋白吸收光譜(極大值,分別在402和490納米)的發光光譜(各自的*大值在468和511納米),而用實線指出。捕獲的圖像的數字蜂窩(負鼠腎臟)跟蹤圖4(a)至圖4(d)中所示的序列,使用高對比度,亮的變體,稱為PS-CFP PS-CFP2,這是市售的克隆載體。PS-CFP2來自PS-CFP的位點定向誘變的多肽主鏈的三個殘基的替換,從而導致更快的成熟和更明亮的熒光(見表1)。PS-CFP和PS-CFP2忍受低pH水平的能力,能夠針對這些探針等酸性細胞內涵體和溶酶體。圖圖4(a)中的中央細胞被選擇,并具有405納米的誘導光轉化(圖4(b))在高功率二極管激光器照射,然后成像*過幾個小時內(圖4(c)和4(D))。續生物合成原生在細胞質中的PS-CFP2*終青色的顏色的光活化細胞轉移作為非轉換成轉換后的蛋白質增加的比例。
無論小缺點,PS-CFP為高對比度的蛋白質標記是非常有用的,并已成功地應用在雙基色的比例成像實驗,包括貨物交換兩個內體之間的直接可視化(*次)。此外,本機和光活化的物種之間的對比度高的水平比,無論是PA-GFP或點燃熒光蛋白(KFP-1 )更加明顯,但Kaede(后兩個熒光筆討論相同的比例下文)。PS-CFP激烈的405納米光曝光之后,進行了5倍的減少,在青色熒光綠色熒光并發300倍的增加,導致約1500倍的光學對比度比(增加至2000倍PS-CFP2)。光敏引發這種程度相對較高的對比度,一起聚集在體內缺乏,應使蛋白質販運細微特征的分辨率誘導自締探頭沒有任何瑕疵。PS-CFP的另一個有用的特性是能夠可視化和記錄數字圖像的探針,使用流行的增強型青色熒光蛋白(ECFP)和標準的熒光素(FITC)熒光濾光片組合。PS-CFP還可以,低到中等的激發強度,,作為pH穩定的青色標簽與其他熒光蛋白受體的細胞動力學和熒光共振能量轉移實驗例程調查。
PS-CFP 402納米的*大激發光子吸收過程中的發色基團是中性的。然而,傳統的質子綠色熒光蛋白的衍生物,這種現象稱為激發態質子轉移(ESPT)綠色光子發射前發生的情況不同,PS-CFP發出青色部分的可見光光譜中的光子(*大約468納米)。激發態質子的傳輸速率可能會減少這種探頭由于質子轉移網絡進行修改,由生色環境。然而,有趣的是,要注意的是強烈的照射紫外或紫色光產生一個不可逆的變換,從野生型GFP相同的機制為質子化的去質子化的物種。這些結果表明,ESPT的調控,影響到幾乎所有的熒光蛋白,應該設計新的熒光蛋白質的光轉化為候選人時,首要關注的。
與PS-CFP之間的潛在的問題是,不像許多光活化和隨后的成像轉換后的物種,需要一個不同的波長的光熒光筆,PS-CFP使用相同的波長,在這兩個過程的不同強度。其結果是,PS-CFP光轉換和未激活的結果往往續激活由紫色激光(即使是在相對較低的光成像所需的水平)的混合物中的青色和綠色信號的同步跟蹤。此工件可避免的,在許多情況下,由成像只有綠色的熒光的光轉換物種。另外,PS-CFP是稍微更敏感的光漂白比增強型綠色熒光蛋白,這可能會出現問題,在某些實驗中。PS-CFP比例成像實驗,應謹慎對待,因為光源激發波長為青色組件的光電轉換波長重疊,需要小心平衡。*后,分離青色和綠色發射光譜PS-CFP比分離綠色從其他光學熒光筆的紅色發射是比較困難的。其他突變及相關熒光蛋白家族的努力有一個顯著的潛力,產生了許多新的有用的青色波長區域的變種。
非水母光敏熒光蛋白
已開發出多種有趣的和潛在有用的光學熒光筆礁珊瑚和海葵物種克隆的熒光蛋白。的*和*重要的例子之一,從石公開的腦的珊瑚,Trachyphyllia geoffroyi一個四聚體的分離的熒光蛋白,已發現到photoconvert在紫外光的存在下從綠色到紅色的熒光發射。有趣的是,要注意發現這個熒光筆發生時,研究人員意外地留下了一個試管中的蛋白質在實驗室長凳附近一個窗口,然后敏銳地觀察到從綠色到紅色的轉變。不尋常的色彩過渡,促使研究者的蛋白質命名為Kaede,日本槭樹,由綠色變成紅色在秋季的幾個月后葉。原Kaede蛋白分離通過創建一個互補DNA文庫和篩選熒光細菌轉化。與PS-CFP資格的情況下,在Kaede的熒光的光轉化發生的光的吸收光譜不同于成像所需的照明帶(參見圖1中的第2欄)。Kaede光熒光筆380和400納米的結果分別在主極大的轉變,從快速的光譜在508納米(吸收)和518納米(排放;見圖5),以較長的波長峰值在572和582納米之間的光照射。
光電轉換后,Kaede呈現紅色綠色熒光比率(約2000倍,同時考慮減少在綠色和紅色排放的增加)的顯著增加。轉換是穩定的和不可逆的,在有氧條件下,既不暴露到黑暗長時間也不是能夠恢復綠色熒光生色570納米的強光照射。Kaede生色紅色熒光狀態是綠色的亮度和穩定性方面相媲美,而且由于未轉化的蛋白質發出熒光很少*過550納米的紅色信號強,外觀提供了出色的對比度。已發現大星珊瑚(mcavRFP ;衍生陰莖海綿體從Montastraea),軟珊瑚(來自DendFP ;成員-木屬),和蘑菇珊瑚(rfloRFP衍生的相關蛋白質能夠紫色和紫外光照射的光轉換從Ricordea佛羅里達州)。所有這些熒光筆(包括Eos的,在下面討論)含有發色基團是來自于三肽- 酪氨酸 - 甘氨酸,初步形成一個紅色的狀態,直到驅動的綠色熒光的光,而不是化學氧化的情況一樣,有許多紅色熒光蛋白來自珊瑚。在這個類中的光學熒光筆呈現**的色彩過渡性質的探頭光學標記的亞細胞器,甚至整個細胞的*的候選人。此外,使用光譜成像檢測器系統在共聚焦顯微鏡觀察時,在特定的細胞中,可以采用定義為個別的監測和篩選目的的單獨的圖像頻道中的綠色到紅色的熒光發射率轉移。
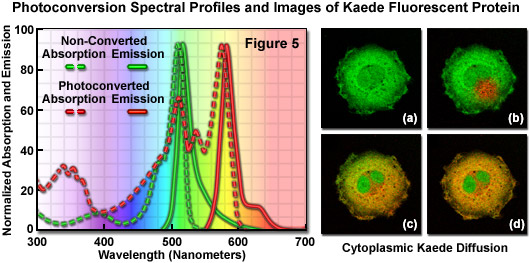
如圖5所示的吸收和熒光發射光譜的自然光轉換Kaede,隨著一系列的圖像的非融合的Kaede熒光蛋白(缺乏亞細胞定位的合作伙伴)擴散在整個細胞質中的一個孤立的負鼠腎上皮細胞。非變頻Kaede吸收和發射光譜圖中的綠點和破折號概述,而紅點和破折號表示的光轉換Kaede型材。注意光譜的兩對相對較小的斯托克斯位移(Stokes shift)(約10納米),但大的間隔距離(60納米)之間的綠色和紅色的發射*大值。的數字圖像序列(圖5(a)至圖5(d))示出綠色熒光發射前從Kaede光轉化(圖圖5(a)),和后不久,用405納米二極管激光器的選定區域的照明(圖5(b))中的紅色區域。光轉換Kaede慢慢地擴散在整個細胞的細胞質中(圖5(c)和圖5(d)),但不進入細胞核兩張。當成像在較長的時間內,繼續Kaede蛋白質的生物合成的轉移細胞質中的整體顏色從橙紅色至黃綠色作為原產轉換Kaede緩慢增加的比率。
基于PA-GFP的類比與激活的事實,微酸性的環境中促進后,調查人員推測Kaede蛋白發色團的*有可能發生光轉化的質子照射時(而不是中性)種用紫外線或紫光。當被使用時,在365至400納米范圍內的照明光轉化動力學是快速的(表現出半衰期為約30秒)。然而,由于增加朝藍紫色區域照射波長(440納米)的轉化率顯著下降,并*終完全停止在470納米以上的(雖然仍然觀察到綠色的發光強度逐漸減少,)。
周圍的組氨酸,酪氨酸,甘氨酸三肽在Kaede生色中心的建議的機制驅動光電轉換定位在62-64殘基肽骨干。這些氨基酸形成的咪唑啉酮的發色基團(類似的多管水母蛋白)轉化在更短的可見光和較長的紫外線的波長從綠色變為紅色熒光照明下。照射誘導裂解之間的酰胺氮和高度共軛的雙咪唑環系統,這個過程需要由完整蛋白質的催化產生戲劇性的轉變中的紅色波長的熒光發射(與隨后形成的組氨酸殘基的α-碳原子的;圖6)。標新立異化學此生色過渡參與應為熒光蛋白的工程師提供了一個很好的基礎,開發更*的光學熒光筆。
其他珊瑚礁物種,如上面所討論的已分離出具有性質類似于Kaede的熒光蛋白。例如,石珊瑚法維亞的瘌痢,取得了一個有前途的四聚體衍生物,具有高效的光電轉換后,從綠色到紅色熒光發射波長與近紫外或紫光燈的照射。基因工程的努力的基礎上的這種蛋白質的結構分析產生的變體,稱為KikGR(命名后Kikume以示,日本術語法維亞)數倍的亮度比在綠色和紅色的狀態,當在哺乳動物細胞中表達時,Kaede。市場上可買到的名稱Kikume綠紅的光熒光筆已被證明是成功使用多光子激發的光轉換為760納米,它可用于具有高空間辨別在厚組織的細胞特異性標記。此外,Kikume熒光筆具有更廣泛的綠色和紅色發射*大值(75納米)的分離比Kaede。
已被隔離軟珊瑚的珊瑚中和名為登德拉的(來自屬名,DEND的前四個字母的縮寫,? ED 一個 ctivatable的)的另一個**的熒光筆進行綠色到紅色的光轉化。登德拉*初分離的四聚體,被轉換成一個真正的單體通過位點定向誘變,得到一個紅色的物種,可以使用紫外線或藍色光,可以將光轉換成綠色的熒光探針。光電轉換后,登德拉呈現紅色熒光的4000倍的增長,并表現出顯著的耐光性。不像許多的多管水母蛋白變體,成熟的Dendra和綠色發色團在很寬的溫度范圍內是非常有效的,從20至37攝氏度。一個商業版,Dendra2,包含一個單一的氨基酸為丙氨酸,纈氨酸取代,第224位(A224V),從而導致光電轉換之前和之后的較完整的成熟和更亮的熒光。在高強度使用488納米激光能力photoconvert將Dendra是**的,其他的綠色到紅色光熒光筆需要更多的紫外線光毒性或紫外線(405納米)的光。然而,謹慎調整時,應使用488納米的激光成像登德拉的,以避免不必要的光轉化。
其中作為光學熒光筆Kaede家庭中使用的蛋白質的優點是大的分離在所需的高效率的光電轉換和隨后的觀察(在60和75納米之間)之間的吸收帶的峰值波長的,使一些激光器中的應用進行實驗。例如,用405納米的藍色激光二極管誘導光轉化的照射后,圖像采集可以很容易地完成,在488納米和綠色或黃色的氦氖激光器工作在543納米或594納米氬離子激光,分別。請注意,沒有會引起進一步的觀測波長的光轉化熒光筆。雖然很容易選擇的感興趣區域的光轉化,使用共聚焦顯微鏡觀察,也可以被成像的蛋白質,與傳統的寬視場熒光顯微鏡配有適當的過濾器的組合。在下行路上,許多的珊瑚礁珊瑚和海葵蛋白的是專四聚體,包括主Kaede衍生工具,導致形成聚集的傾向時,熒光筆其他蛋白質融合。在許多情況下,這件神器將限制Kaede及其親屬使用散裝的細胞質細胞的跟蹤調查。進一步的基因工程涉及四聚石珊瑚光學熒光筆的努力可能*終產生是有用的的單體衍生產品,融合結構,討論如下。
礁珊瑚EOS熒光蛋白
另一種四聚體,石珊瑚(Lobophyllia hemprichii)的,稱為熒光蛋白類似Kaede EosFP(命名后,希臘神話中的黎明女神Eos的 ;見表1),發出明亮的綠色熒光,在516納米轉移到橙紅色(581納米)用紫外光照射時,在波長為390納米的近紫外區域中。在這種情況下(如上面所討論的與Kaede蛋白),譜移所產生的光引起的變形例,相鄰的發色基團的肽主鏈中包含一個停頓。已經采用兩個單點突變野生型成二聚體亞基的四聚體,其中每一個都能夠被并入保留正常的生物學功能的蛋白質,具有多種功能的融合構建分割。此外,串聯二聚體(tdEos)的變體具有蜂分隔的一個12氨基酸接頭的熒光蛋白質序列,其中包含兩個副本。的串聯二聚體的成熟在攝氏37度的溫度下有效地和有效的行為作為單體的融合產物,盡管以兩倍于分子的大小和重量。
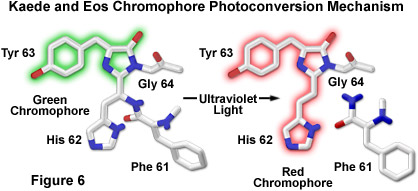
到的野生型EosFP的四聚體通過引入單點突變的組合,功能性單體蛋白已被創建,它被簡稱為mEosFP“ 。類似的二聚體亞基,單體能夠被納入作為活細胞成像中的標記的功能性生物嵌合體,雖然單體融合只在攝氏30度以下的溫度下(在哺乳動物系統中限制了它們的應用程序的功能性表達) 。熒光筆蛋白的熒光光譜表明pH值依賴于光轉化,表明生色團的質子化形式的激活,這是一致的激發態質子轉移機制是必要的。EOS肽骨干裂解綠色到紅色的光轉化過程中也被觀察到Kaede和KikGR熒光蛋白(如上所述,見圖6),配有類似熒光筆特征。事實上,Eos的,登德拉,Kaede生色團可能*終證明是相同或同分異構體的結構,但組氨酸(His62)殘基在KikGR生色團意外地適應一個順式配置,而不是安排為圖6中所示的反式紅色光轉換物種。
**的綠色到紅色光熒光筆**為止發現的礁珊瑚蛋白質中肯定保證積極努力,重點解決與聚合相關的問題,以及微調光敏要求和成像光譜。工程迅速地在37度的變體的成熟,Eos的單體蛋白,它具有的光學性質非常相似,Kaede,應該要更加有用,由于顯著降低的傾向,形成在體內的融合蛋白之間的分子間的關聯的表位標簽。在未來,工程光學熒光筆蛋白變速光轉化照明波長的藍色和綠色光譜區域,這是顯著減活細胞的毒性,加上黃色熒光發射的變化通過遠紅光的波長帶的,潛在的應用Kaede和EOS衍生探頭可以大大擴展。
Kindling熒光蛋白(KFPS)
一個有用的非水母光的熒光筆,點燃熒光蛋白(KFP1)的已被開發非熒光生色分離Anemonia蘇卡達,現在是商業可用。,慢性點燃熒光蛋白不表現出發射,直到照明的綠色或黃色的光,在525和580納米之間的區域。在瞬態紅色熒光(火種),在580和600納米,*大激發和發射,緩慢衰減的照明停止時,作為蛋白質放松返回到它的初始的非熒光的狀態(表現的半衰期低強度的光的結果約50至60秒)。強烈的藍色光照射淬火立即完全點燃熒光,允許嚴格控制熒光標記。請注意,與低強度的綠色光和藍色光的熒光淬滅兩個火種為野生型蛋白的可逆過程。在對比度,高強度的照明或者續照射在中等水平導致不可逆的點燃與熒光強度約30倍,*過的非活化的蛋白(參見圖1中的第3欄)。不可逆點燃分子不失去它們的熒光,并與藍色光的照明不滅。此功能允許長期穩定高亮的細胞,組織和細胞器PA-GFP和其他熒光筆蛋白相似。
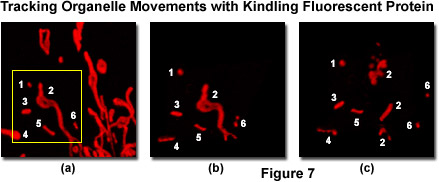
圖7中給出了一系列的跟蹤使用的火種熒光蛋白(KFP1)的培養基中培養的真核細胞線粒體的圖像。負鼠腎皮質近曲小管上皮細胞(行線)轉染的質粒載體含有KFP1融合到線粒體靶序列,并轉移到一個活細胞成像室。一個典型的場(圖7(a)條),氦氖激光照射在543納米,用3%的功率輸出,建立標記線粒體單個細胞內的分布格局。這種激光的功率電平誘導可逆的火種在所有的標記線粒體啟用可視化的大小和位置。接下來,一個地區的利益被勾勒出來(黃色框;圖7(a))和40%的激光功率輸出不可逆轉地點燃了線粒體在選擇區域中,照明用的457納米譜線氬照射離子在2%的功率激光淬火可逆點燃的可視化領域內線粒體。不可逆點燃線粒體一段時間為15分鐘,使用1%的功率氦氖激光跟蹤。圖7(b)和圖7(c)示出的KFP1標記的線粒體在5分鐘內(圖7(b)和15分鐘(圖7(c)),證明跟蹤遍歷的微管網絡的細胞器。請注意在較長時間尺度的線粒體發生碎裂。
其他定點突變本地海 葵生色(ASCP)和幾個變種的努力,已經建立了一系列新的火種,可以激活(日光燈)和滅活(非熒光)狀態之間的可逆的光轉換熒光蛋白。海葵點燃蛋白質表現出熒光橙紅色區域的可見光譜的吸收有極大的型材約580納米的發射峰從600到630納米不等。各路這些變種之間的黑暗,點燃狀態接近光學對比度增強70倍。然而,半衰期短展出點燃狀態,防止使用這些探針作為一個長期在體內跟蹤了解亞細胞動力學研究有針對性的活化熒光標簽。無論如何,能夠精確地控制熒光信號強度是在擁擠的環境中追蹤粒子的運動時,特別是有用。例如,火種熒光蛋白已經被成功地用于跟蹤在開發非洲爪蟾胚胎和個人PC12細胞中線粒體的運動神經板細胞的命運。目前的研究努力的方向努力開發更*的火種熒光蛋白可以激活的時間較長。
使用位點定向誘變在點燃的熒光蛋白的熒光激活的機制調查表明,在位置64中的發色基團在空間上鄰近的酪氨酸殘基的氨基酸的光轉化反應是至關重要的。生色團的電荷分布,分子構象的變化或其他環境變量是*合理的解釋這些結果。大多數綠色熒光蛋白變體的中性和陰離子的種類有顯著不同的激發光譜,但點燃的蛋白質的激發*大值是非常接近的光轉化前的*大吸收。這一觀察到一個假設,即另一種現象是負責點燃效應變得可信。的基礎上的結構模型,X-射線衍射分析,和突變的結果,已經提出了一種機制,涉及光子引起的異構化反應的發色基團的酪氨酸殘基的背后作為基本的驅動力轉換成熒光狀態的蛋白質。支持這一理論派生的能力,轉化到點燃火種和非熒光發色團的熒光蛋白,通過適當的氨基酸替換。
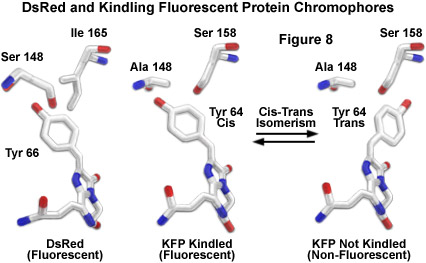
在圖8中示出的示意性的分子模型DsRed和發作和非發作形式KFP1展示的生色團之間的類比。的碳原子,而氧和氮原子中的紅色和藍色的顏色,分別表示,為白色枝。的紅色熒光蛋白的第66位的酪氨酸(相等于的Tyr64,KFP1)的相鄰的殘基是異亮 氨酸165和絲氨酸148。該模型生成在火種蛋白的熒光涉及激發的熒光發色團的順反異構化(圖8)。曾有人建議在點燃的發色團(DsRed的異亮氨酸,圖8)的158位的絲氨酸殘基的關鍵,以穩定的酪氨酸66反式構型的殘余物在(非熒光狀態)。激勵點燃生色團,使酪氨酸64個殘基異構化順的位置,從而產生熒光。這一假說已經得到為纈氨酸取代,第158位的絲氨酸的突變體,其中的建設。突變體失去所有火種屬性和自然熒光,貸款由纈氨酸甲基,立體禁止轉化為反式異構體的染色體(非熒光)被封鎖狀態的理論證據。
所有海葵火種檢查蛋白質的主要缺點是他們的傾向,聚合成四聚體,從而嚴重影響的潛力沒有一定程度的干擾正常的生物過程用于蛋白質標簽。然而,點燃蛋白質批量光化學法和跟蹤個別的細胞器和細胞內人口眾多*的候選人。點燃的蛋白質的其他優點包括紅色和遠紅光的熒光發射光譜的檔案,這有利于它們的效用多色標記實驗中,青色和綠色熒光蛋白。此外,點燃過程的可逆性允許調查前檢查整個熒光圖案的標記細胞不可逆轉的特定區域的光化學法。作為一個額外的好處,脫水點燃蛋白保留可逆的光轉換的能力,并因此可能在生產的光致發光膜,光化學的存儲單元,以及各種其他的納米技術的應用提供了有用的服務。
Dronpa:讀擦除 - 寫于光燈開關
新一代可逆的開關切換功能的專業光學熒光筆預示通過引入來自Pectiniidae,一個家庭的幾個成員,自然散發出淡淡的熒光紫外線照射后的石礁珊瑚,單體熒光蛋白Dronpa。融合后的忍者長期消失(德龍)和光敏(PA)的名字命名,Dronpa表現出不尋常的,因為它能夠切換熒光照明兩個不同的激發波長的光致變色行為。使用兩個定向隨機誘變,以產生野生型低聚物具有重大的*大吸收波長為503納米,和在中性pH值小峰在390納米的熒光蛋白的單體的版本被設計dronpa。在503納米的吸收峰是由于該蛋白的去質子化的物種,而較小的峰在390納米來自質子化形式。當在488納米照射的去質子化的物種的熒光發射光譜的檔案有一個*大的,在518納米具有相對高的量子產率為0.85。與此相反,從質子化的蛋白質幾乎是無熒光的。光控Dronpa發生去質子和質子形式的光學熒光筆之間相互。在488納米強烈照射后,其蛋白質人口是非常有效驅動質子物種,承諾減少熒光暗淡(關閉)狀態,其中390納米吸收峰為主。在朦朧的狀態很容易轉換回原來的熒光燈(上)去質子化狀態以*小的照度在405納米。
除了 事實,Dronpa熒光強度大大*過了增強型綠色熒光蛋白(EGFP ;見表1),*顯著的特征,這種光學熒光筆速度在488納米(生產綠色發光)的光激發后,它可以很容易地全面恢復,通過隨后的照射在405納米(如上所討論的,參見圖1的第4列)。需要注意的是光活化Dronpa需要少得多的光子的能量,比光控的非熒光的狀態(這兩個過程的量子產率比為*過1000)。其次是激活失活這種模式可以不斷重復和PH值不敏感,表明一個潛在的真正**的能力,可逆的光控熒光嵌合融合產品。主要的缺點是比較快的光控率非熒光質子化的物種的Dronpa在488納米照射時,限制,可被光活化后收集的圖像的數目。然而,審慎使用中性密度濾光片,或小心地控制激光衰減(聲光可調諧濾波器的AOTF)應使處于激活狀態的能力,捕捉多個圖像的Dronpa標簽蛋白。
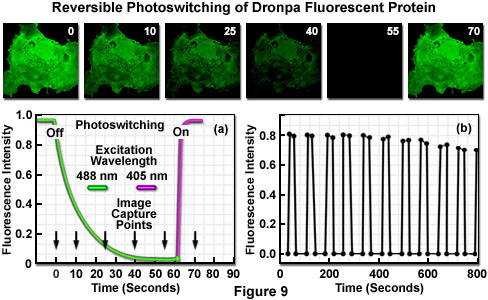
可逆的光控的Dronpa熒光如圖9所示,使用一個孤立的轉化的非洲綠猴腎細胞(COS-7行),在培養基中培養。貼壁培養轉染的一個向量,包含只的Dronpa蛋白基因(沒有亞細胞融合目標)和生長在活細胞成像室。*初非常明亮的綠色熒光激發波長為488納米(圖9,圖像的時間點= 0秒)慢慢變淡后觀察一段50秒到60秒(圖9(a)和時間點的10到55秒),檢測不到在中等程度的照度水平。熒光筆轉換的去質子化,以質子化的物種的衰減曲線(綠色),圖9(a)中示出。光敏化后,使用405納米二極管激光器(紫色曲線在圖9(a)),Dronpa熒光完全恢復。衰落之后通過光活化熒光恢復的順序重復*過10個周期(圖9(b)),揭示的初始熒光強度完全康復Dronpa的慢慢減小續輪。10個循環后,在此試樣的Dronpa回收的熒光強度降低到初始值的88%的,但可以迅速地重復光控周期(毫秒時間尺度上)與*過100回合的孤立的單一的蛋白質分子。
光致變色(熒光和關閉切換的能力)雖然已觀察到野生型和幾個黃色熒光蛋白變種維多利亞多管水母 GFP在單分子水平,都沒有表現出這種現象,測量時散。在這些研究中,在488納米處的照度數分鐘,產生的分子熒光幾秒鐘,隨后同樣短的時間間隔,沒有發射,隨后再次恢復發射。被稱為閃爍的行為,這和關斷開關序列可以重復許多次每個綠色熒光蛋白分子前約一百萬的光子的發射時,*終達到*終的長壽命的非熒光的狀態。明亮的狀態可以恢復為五分鐘內重新啟動的順序由488納米激光照射前照射紫外光(405納米)。以這種方式,許多原生的綠色熒光蛋白衍生物顯示光誘導的切換效果,其中每個分子是單獨可尋址的。然而,能力強的大型Dronpa標簽分子合奏(包括細胞器和整個細胞)集體行動的能力,寫,擦除和非破壞性讀取信息作為信息存儲介質,具有效率高,是真正的領域獨樹一幟的熒光蛋白。
實驗設計的實際考慮
熒光筆熒光蛋白利用光學設計實驗時,應考慮的幾個重要方面,關于活細胞成像,顯微鏡配置,載體構建,和蛋白質的選擇,以優化圖像采集參數。這些**的探頭主要用于監測活細胞中的動態過程,這往往需要保持細胞培養顯微鏡舞臺上長時間處于亞健康狀態。各種專門的加熱成像室制作舞臺插入市售的長期細胞在顯微鏡維修,但研究者也必須考慮一些必要的輔助要求,如二氧化碳源,輕緊顯微鏡外殼,和振動隔離。總之,成功形象長時期的活細胞必要的實驗條件下,應仔細著手與光學熒光筆蛋白實驗前成立。
光學熒光筆熒光蛋白質上述幾個可以成功使用傳統的寬視場熒光顯微鏡技術成像,但嚴重的定量調查,涉及的漂白方法和光敏往往必須配備專門的激光系統的多光子共聚焦顯微鏡進行。具體而言,PA-GFP,PS-CFP,Kaede,EosFP,Dronpa所有需要近紫外或紫色的照明光活化或光轉化,但成像的蛋白質所需的較長波長的光源(藍色和綠色激發)。因此應配備的紫外或紫色激光,以及可見光激光器,發射藍色和綠色光譜線,共聚焦顯微鏡。當下*流行的激光光學熒光筆配置,雖然紫外線高能量的氬氣,二極管泵浦固態二極管405納米,488納米氬離子,和一個543納米的氦氖,氦鎘激光可作為光敏(牢記潛在的細胞損傷工件可以用紫外線照射)。其他有用的成像激光器包括一些新的二極管和氦 - 氖模型和多光譜氪 - 氬系統。*好的多儀器配置與寬帶鈦藍寶石激光器的波長范圍在750納米到1100納米之間的可調輸出。
照明光轉換和光活化過程中的具體區域的劃分是*有效的聲光可調諧濾波器(AOTF),可以很方便地用來定義選擇圓形,橢圓形,矩形或手繪照射試樣進行。AOTF還可以進行微調激光功率水平調節強度試樣,并能夠使用的技術被稱為高速通道切換或multitracking的順序掃描標本。這種方法使排放的順序激發和收集一些熒光探針,以避免出血,通過文物,更準確地單獨的發射光譜。定義地區的廣角鏡的興趣,提出了更大的挑戰。研究級顯微鏡通常配備照亮選定區域中的試樣,可以進行調整的可變光圈,雖然用少得多的精度比共聚焦顯微鏡的聲光可調諧濾波器的系統。廣角儀器也必須配置專門的熒光濾光片組合以圖像的幾個光學熒光筆蛋白。相比之下,共聚焦和多儀器更適合定量分析細胞動力學,利用光電轉換和光活化技術比寬視場顯微鏡,因此應為這些應用的*。
光學熒光筆探針的選擇應取決于具體的實驗要求的宿主細胞系統,參與調查,它可以包括膜,細胞器,核酸和蛋白質的生物目標。在一般情況下,單體的熒光蛋白的亞細胞定位實驗中使用的融合載體,大大優于那些形成高階的聚集體(主要為二聚體和四聚體)在體內的表達。例如,Kaede是一個預留的四聚體可能無法達到預期效果融合時感興趣的蛋白質的光轉化實驗。而是選擇單體版本的聚EosFP或PS-CFP熒光筆確保成功的概率更大。在本文中討論的幾個光學熒光筆是市售的,并包含在宿主質粒的多克隆位點,其目的是為了使含有廣泛的限制性核酸內切酶切割位點的互補DNA序列的摻入。這些載體是理想的用于克隆特定的亞細胞定位的靶基因產生的融合蛋白。
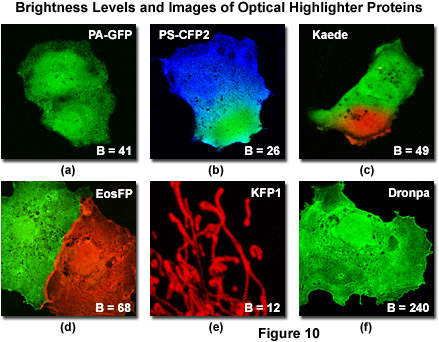
產生足夠高的熒光信號電平為*佳的圖像采集也是使用光學熒光筆時要考慮的一個重要因素。在這方面,可以采用的吸收摩爾消光系數和熒光量子產率的值的本機和光轉換蛋白物種,以此來衡量,以確定相對的亮度水平。例如,Kaede和mEosFP都具有相似的光譜帶寬配置的可見光光譜中的綠色(母語)和紅色(光轉換)地區。然而,Kaede的固有綠色形式大約有綠色mEosFP由于到一個更高的消光系數和量子產率的熒光發射強度或亮度電平的兩倍。因此,在光電轉換之前,成像信號 - 噪聲比Kaede遠高于mEosFP。光電轉換后,這兩種蛋白具有類似的亮度水平(見表1),并產生媲美的圖像。在當前可用的光熒光筆蛋白,Dronpa,Kaede,mEosFP的是*亮的,其次是PA-GFP,在亮度電平的光轉換Kaede物種類似,但顯著低于天然蛋白。市售的PS-CFP2變種是大約一個半光亮如Kaede,而火種和PS-CFP蛋白質,無論是在本土和光轉換形式,是***暗的光熒光筆,收益率只有約25%的亮度電平表現出的光轉換的Kaede(表1)。后者熒光筆生物目標具有低豐度的水平,或需要高成像速度的調查計劃時,應考慮的一個因素,在成像過程中,表現出顯著較低的信號信噪比。
如圖10所示,是幾個比較有用的光學熒光筆在本次審查討論了一系列的*佳條件下拍攝的數字圖像。此外,圖中為每個蛋白(光活化或光轉化后)的綠色熒光蛋白的熒光強度的百分比列出的亮度電平。的亮度等級是由該產品的摩爾消光系數和熒光量子產率(在*大吸收)。請注意,圖10和表1中列出的亮度值會有所不同,基本上,當被激發的熒光蛋白質固定的激光光譜線時或使用更寬的帶寬,所產生的電弧放電燈耦合到帶通激發濾光片離峰。此外,熒光蛋白的亮度水平可以大幅波動,從細胞到細胞,尤其是在瞬時轉染不同數量每單元結果吸收大大不同程度的表達質粒載體。點燃熒光蛋白(KFP1,圖10(e)條),這是定位到線粒體異常,熒光筆熒光蛋白如圖10所示的光學耦合融合伙伴,往往會擴散到整個細胞質和細胞核。的的熒光筆蛋白圖像(圖10(b)和圖10(c))被抓獲后極短的一個選定的區域具有高強度的紫激光的光轉化,前光轉換的物種能夠擴散到整個細胞質中。
結論
來自各種各樣的海洋物種數量不斷增加的熒光蛋白的生物學作用的復雜的相互作用才剛剛開始被理解。光致變化的自催化的發色團,包括光活化和光轉化,可作為高度發展的光保護機制,以協助這些生物中的有用的高能量的陽光下,特別的損害更短的波長的功耗,通過吸收和隨后的熒光再發射波長更長和更安全的。在許多情況下,這些顯著的熒光蛋白顯示很高的耐光性和動態光誘導相變特性,包括光譜微調共振能量轉移給體 - 受體對(甚至級聯)。大量的光譜變量已經發現,具有排放概況,覆蓋了整個可見光譜表明,這些蛋白質的各種光學和生化特性,會產生一系列新的候選人作為探針進行生物調查,并確保持續發展的**的基因工程熒光蛋白質。
能夠有選擇性地啟動或改變光轉化光學熒光筆蛋白的熒光分布呈現這些探頭作為*的工具,探索蛋白質在活細胞的行為。熒光筆的熒光強度(光譜或顏色)發生后,才光子介導的轉化,新合成的的非光敏蛋白池無法觀測到的,不復雜的實驗結果。這個信號獨立于新的蛋白質的合成,可能會啟用的技術,如光脈沖的標簽和監測隨著時間的推移的熒光標記的分子的蛋白質的降解動力學的研究。額外的量化技術,包括熒光相關光譜(FCS),應該證明有用的衡量流動性的光敏光學熒光筆在小數字,甚至下降到單分子水平。
光活化及經光光學熒光筆一般是迅速的,并產生穩定的熒光信號。因此,這些探頭可用于研究各種標簽蛋白的動力學性質,如擴散系數,分數的流動性,房室居留時間和匯率。在許多情況下,光電轉換FRAP和FLIP比傳統漂白技術提供了更大的靈活性。此外,在發展中的有機體的細胞系或易位可以很容易地監測成像光活化后的單細胞或亞細胞熒光分散。在這些方面,光學的熒光筆表現出***的承諾,補充和擴展目前熒光蛋白成像應用的范圍。
許多礁珊瑚的熒光蛋白光熒光筆專四聚體性質往往嚴重限制了它們的應用程序,在體內生物的結構和功能的調查作為融合蛋白標簽。一旦表達,可以制作形成的四聚體異常定位,擾亂正常的功能,或限制的融合產物聚集在一個特定的細胞器或細胞質中。熒光蛋白融合,如肌動蛋白,微管蛋白,或小窩,其本身參與在自然低聚物形成的合作伙伴時,這種效果是特別顯著。創建熒光蛋白單體的基本策略涉及重復的位點定向誘變破壞四聚體的接口,通常是由疏水性和中性基團的親水性或帶電荷的氨基酸取代。熒光量子產率的顯著下降,因為通常伴隨遺傳修飾的,圓的隨機誘變是經常要救援熒光。
由于光學熒光筆繼續發展,熒光蛋白,可用于光學標記應走向光明的發展,具有高對比度,可以很容易光轉換和顏色的發射,顯示了廣泛的單體衍生物。例如,能夠可逆的光活化,紅色到綠色的光轉化,在升高的溫度下改進的表達,在遠紅外或近紅外光譜區的發射和衍生物的蛋白質,將是特別有用的。加上這些進步將變得司空見慣,顯微鏡配備之間的順利過渡照明熒光觀察模式和區域標記在大多數細胞生物學實驗室。與*的熒光共振能量轉移和多光子激發技術,如光活化和光轉化的組合,可使蛋白質動力學的研究,以更高的精度和空間分辨率。*終,這些創新有潛力做出顯著成績的信號轉導系統在空間和時間上的動態。



