奧林巴斯顯微鏡:多光子熒光顯微鏡簡介
多光子熒光顯微鏡是一種強有力的研究工具,它結合了先進的光學技術,長波長多光子激發激光掃描顯微鏡捕捉到高分辨率三維圖像高度特異性熒光標記標本。

該方法是特別有用的細胞生物學家的努力來研究活體細胞和組織的動態過程,而不會造成顯著,往往是致命的,損壞的標本。雖然經典的寬視場熒光顯微鏡在生物系統中的生化事件通常可以提供亞微米分辨率,該技術是由引起的二次熒光位于焦平面上方和下方的整個區域的背景噪聲的靈敏度和空間分辨率的限制。
多光子顯微鏡的激發只發生在一個的衍射有限的顯微鏡的焦點,提供的能力,以獲得三維分辨率光學部分厚的生物標本。個人光學部分獲得通過光柵掃描標本在xy平面,一個完整的三維圖像是由連續掃描標本在連續的Z位置。多光子熒光的焦點的位置,因為可以精確地確定和控制,是非常有用的,用于探測下方的試樣表面的選定區域。的高度局部化的激發能量供應,以盡量減少光漂白的熒光基團連接到試樣,并降低光損傷,從而增加了細胞的活力和隨后的持續時間的實驗,調查活細胞的性質。此外,近紅外激發波長的應用程序允許更深入地滲透到生物材料,并減少觀察在較短波長的光的散射程度高。這些優勢使研究人員能夠厚的活組織樣本,如腦切片和發育中的胚胎,這將是困難的,如果不是不可能的,與其他光學技術的圖像進行實驗。
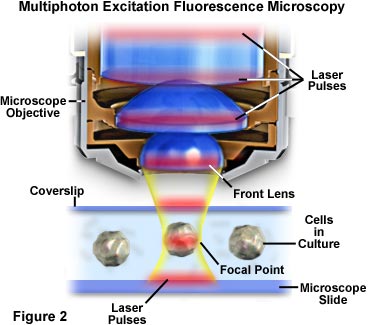
在圖1所示的是一個典型的配置中使用的多光子熒光顯微鏡實驗。顯微鏡是一種倒置式的儀表設計,觀察活細胞的組織培養和較厚的生物標本沐浴在生理鹽水。對于常規的非熒光觀察,透射燈箱定位以上的階段,使標本可視化,通過常規技術,如明場,微分干涉對比,相位相反,和Hoffman調制對比度。雖然沒有用的多光子應用中,有35毫米照相機主體連接到該端口,在前面的圖1中所示的顯微鏡,采取與現有的照明來拍攝圖像的基礎上。顯微鏡主體的右側的Ti(鈦):藍寶石模式鎖定脈沖激光系統,是由于多光子激發的峰值強度高,但較低的平均功率的優選來源。控制激光是通過位于頂部的激光柜,被接合到顯微鏡端口策略性地放置的中繼反射鏡的光波導或直接耦合或者通過光纖耦合的電子單元。在顯微鏡基地過濾光電倍增管檢測系統連接到另一個端口,是一個XY光柵掃描單元,可以迅速偏轉聚焦激光束在物鏡領域。隨附的計算機工作站,可以從光學部分組裝三維重建顯微鏡所收集的數字圖像處理和分析。
傳統的寬視場熒光顯微鏡困擾的二次熒光遠離震源區,這有助于天賦和高背景噪聲信號發生,往往掩蓋了重要的標本細節。共聚焦顯微鏡規避了這個問題,在很大程度上,通過針孔孔徑,產生薄(小于一微米)unblurred光學部分由深厚的標本內使用拒絕的焦點的背景熒光。多光子熒光顯微鏡的引入提供了一種新的替代共聚焦顯微鏡,可通過選擇性的激勵耦合到檢測范圍更廣泛的選擇。不同于傳統的共聚焦顯微鏡中,不需要圖1中的顯微鏡的針孔附近的探測器,發射的熒光信號顯著提高的效率達到三維歧視。在過去,所需的多光子激發的脈沖激光系統的高成本和復雜性的技術具有有限的使用,但最近推出的交鑰匙激光器和商用多光子系統實現多光子熒光顯微鏡的方法給出了很多調查。
雙光子和三光子激發
多光子激發的基本原則,首先描述由瑪麗亞G?ppert - 梅耶70多年前同時進行她的博士論文研究,但假設不能被證實,直到脈沖紅寶石激光器的發明,大約30年后。在高光子密度,可以同時吸收兩個光子(介導的虛擬狀態)相結合,他們的精力去招惹電子躍遷到激發態的熒光。一個光子的能量是因為它的波長成反比,兩個光子的波長大約兩倍所需的單光子激發。作為一個例子,兩個光子的波長640納米(紅色光)相結合,以激發紫外線吸收在320納米區域的熒光團(紫外線),這將導致在較長的波長(藍色或綠色)的熒光發射二次。這種獨特的應用裝置,較長的波長延伸到紅外區域,可以方便地利用激發單量子事件,隨后在較低的波長發射的二次輻射的發色團。
每次激發事件的兩個光子的要求必須的速率常數,取決于激發光強度的平方。雖然光子不必是相同的波長,以引起多光子激發,大多數實驗系統都設計有一個單一的激光源,所以兩個光子通常具有窄的波長分布的特定人群的成員。與單光子吸收的情況下,一個給定的熒光基團,將同時吸收兩個光子的概率是入射光子的空間和時間之間的重疊的函數。基于這樣的假設,每個熒光基團暴露在相同的激光截面的計算表明,光子必須內到達10(-18)秒(1 秒)阿托對方。這種重疊期間的時間尺度是一致的中間虛擬狀態的壽命(10(-17)秒或0.01 毫微微的第二個)。
光子密度高的多光子熒光是必要的,以確保有足夠的熒光團的激發水平。事實上,光子的濃度必須是大約一百萬次,所需的相等數目的單光子的吸收。這是通過高功率鎖模脈沖激光器,脈沖峰值期間產生顯著的功率量,但具有足夠低,不損壞試樣的平均功率。簡短,但激烈,由激光器發射的脈沖增加平均在一個恒定的平均入射激光功率電平對于一個給定的熒光基團的雙光子吸收的概率。最小的平均激勵功率電平降低的單光子吸收的量,這也發生在在激發過程中的試樣。這是單光子激發事件而導致的加熱和一些熒光實驗的過程中發生的光損傷的大多數。
典型的脈沖激光配置采用短的工作周期大約100飛秒(10 E(-13)秒),重復頻率為80?100兆赫的多光子熒光實驗。此機制允許令人滿意的圖像采集沒有過量的熱和光損傷試樣。為每個脈沖的時間刻度,而通常被稱為“超短”,仍然是4至5個數量級不再比雙光子吸收的反應時間。單重態激發的雙光子脈沖的發色團的人口是在傳統的寬視場或共聚焦熒光顯微鏡得到的相同。因此,二次雙光子激發后的熒光發射單光子的實驗中觀察到的沒有區別。甲熒光基團,例如羅丹明,將二次熒光排放相同的寬波長范圍內,不管它是否被激發的一個單一或雙光子激發事件。
三光子激發是將關聯的非線性光學吸收的事件,可以發生類似的雙光子激發的方式。所不同的是,三光子必須與非法過渡到激發單重態的熒光團同時交互的。三光子激發的一個好處是,成功的吸收只需要一個更大的10倍的濃度比雙光子吸收的光子,使得這種技術有吸引力的一些實驗。三光子激發能增強z軸的分辨率更大程度比雙光子吸收。這是由于同時有三個單個光子的相互作用的要求造成的熒光團激發到一個較小的橫截面。在實踐中,發出紅外光的激光,中心在1050納米的波長分布能夠激發熒光,吸收在紫外區(約350納米的激發波長的三分之一)。相同的激光可同時激發另一個熒光基團的一半的波長(525納米),在雙標記的生物實驗中的一個有用的組合。
通過利用較短的近紅外波長(720納米),三光子熒光可以延長進深紫外線的有用的熒光成像范圍。激光波長在900到700納米范圍內將激發熒光基團吸收在240至300納米的地區,這是幾乎無法使用傳統的光學顯微鏡。用玻璃制造的熒光物鏡具有非常低的傳輸波長300納米以下,但波長較長的紅外激光輻射可以很容易地通過三光子激發。
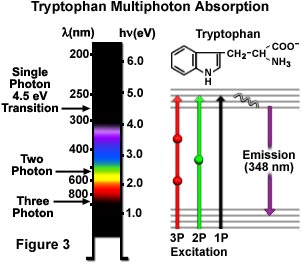
一個共同的芳族氨基酸,色氨酸,單,雙和三光子激發,在圖3中示意性地示出的。4.5電子伏特單光子電子躍遷激發色氨酸在280納米與隨后的二次熒光發射在348納米的紫外區域。激發的雙光子的機制是通過在580納米為中心的黃綠色的光,而三光子激發時,會發生在近紅外區域中的氨基酸與840納米的輻射照射。轉換雅布隆斯基圖中(圖3),該虛擬的狀態表示由雙光子激發和三光子激發了球體的球體。色氨酸具有更強的熒光具有更高的量子產率比其它芳族氨基酸,并且在大多數蛋白質只少量存在。這些屬性應該多光子顯微鏡調查一個極好的工具,使用自體熒光色氨酸殘基。即使高階非線性現象是可能的,包括四光子激發,但這些還沒有被應用到生物學研究。
雙光子熒光顯微鏡
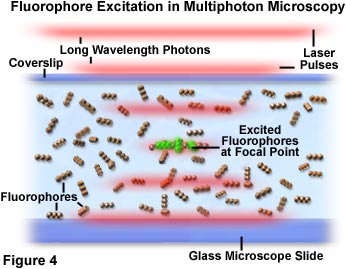
本地化激發該地區周圍多光子顯微鏡的焦點,原因是它在這里,的光子密度最高的。這種優勢從基本的物理原理,由熒光基團的雙光子吸收激發光強度的平方的函數的產生。當從一個脈沖激光源的光子聚焦高數值孔徑的物鏡,他們變得更加擁擠,從而增加了兩個或更多個同時與一個單一的熒光基團相互作用的概率。光子顯微鏡焦點集中如此多光子吸收的關鍵,這是唯一的區域發生明顯的激發。的概念,分別在圖2和4,說明宏觀和微觀水平上的多光子激發。圖2示出了夸張的視圖的顯微鏡的物鏡的位置的圖像培養的細胞在顯微鏡載玻片和蓋玻片。紅色激光脈沖穿過的縱向軸線的物鏡集中,集中到該圖的中心部分中的單元格。
在圖4中,光子與熒光團的擁擠和互動表現在顯微鏡焦點。作為紅色激光通脈沖通過含有熒光基團的試樣(表示為球體的線性三重峰),激發的概率隨著脈沖達到的物鏡的焦點。被表示為單個光子漫紅線定義的激光脈沖的邊界分隔成合。一小群被激發震源區的中心定位在圖4中的熒光分子同時吸收兩個光子,并表現出綠色熒光二次。焦平面以外的發色團會吸收兩個光子的概率幾乎是零,因為光子的密度不夠高,在這一地區。
雙光子激發的現象是可能的,這不僅是因為在顯微鏡焦點附近的熒光基團的空間,而且還因為包含在連續的激光脈沖的光子的時間重疊。如上文所述,發生雙光子吸收激發能量在由激光源產生的光子的強度的平方成比例。脈沖激光束的強度下降的焦平面的距離的平方,所以焦區附近的任何地方熒光團的激發概率降低的熒光團的焦平面的距離的四次方。脈沖激光照明錐的尺寸由物鏡的數值孔徑。因此,電子束強度降低相差的焦點激勵光錐的直徑的平方成正比。,作為照明錐し上方和下方的聚焦點,熒光團的激發概率隨著錐體直徑的四次方。出于這個原因,熒光團激發只限于立即周邊地區的焦點,它代表了整個樣品只有一個非常薄的光學部分。
超短激光脈沖持續時間,其測量范圍通常從約100飛秒,1皮秒(10 E(-13)10 E(-12)秒),被認為是在宏觀方面。然而,在吸收光子事件的時間尺度(飛秒約千分之一)的脈沖實際上是相當長的持續時間。這限制了熒光飽和度,并允許分子足夠的時間之前返回到基態脈沖之間激發新一輪的發生。脈沖重復率范圍從大約80至120兆赫(MHz),它提供了激發瞬間峰值功率高,停留時間平均為10納秒。因為一個典型的熒光的熒光壽命僅持續幾納秒,人口激分子有足夠的時間來放松脈沖之間。相對短的脈沖的占空比(脈沖持續時間脈沖之間的時間)除以平均輸入激光功率限制為小于10 mW,值僅稍大,常規的激光掃描共聚焦顯微鏡的。
雙光子激發焦平面附近的區域的限制提供了一個顯著的優勢超過共聚焦顯微鏡的多光子。熒光共聚焦顯微鏡的試樣在整個被激發,而是由檢測器所收集的次級熒光共焦針孔限制物鏡焦平面。這供應量減少背景噪音或添加背景噪聲的數據從其他焦平面的熒光。與此相反,產生多光子顯微鏡熒光激發(其后,熒光發射)只在焦平面,消除背景信號和共焦針孔的必要性。如圖5所示,每個技術檢討漂白型材共聚焦和多光子顯微鏡的激勵模式之間的顯著差異。
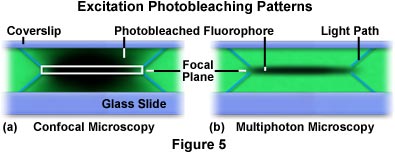
如圖5所示,光模式,從發生反復掃描一個單一的xy平面在福爾瓦的聚合物薄膜與熒光羅丹明(綠色染色)染色的XZ。在左側(圖圖5(a)),通過掃描彩色膜,用共聚焦顯微鏡產生的檔案。在掃描的中心的白色矩形表示的焦平面上,通過針孔,由檢測器成像。對角線突出的矩形的上部和下部的角落的藍線代表由激發光光束透過薄膜的光的路徑。隨著電子束在光柵掃描的薄膜,熒光染料是激發和熒光發射二次。最終,光漂白時,在焦區的暗區所表示的。在掃描共聚焦顯微鏡(圖圖5(a))的膜中,集成的激發幾乎等于整個激發路徑,上方和下方的焦平面上幾乎相等。相反,在xz重復掃描激發輪廓產生的多光子顯微鏡限制激發光漂白的焦平面上(圖5(b)條)。類似于在圖5(a)的情況下,對角的焦平面發出的藍線劃定所采取的路徑由激發光到達焦平面。
來自本地化激發多光子顯微鏡帶來一些優勢。也許最重要的是,可以實現與該技術中,這是相同的一個理想的共聚焦顯微鏡獲得的三維分辨率的高度。此外,由于缺乏以外的焦平面位置的熒光團的吸收,使更多的激發光的穿透試樣,達到對焦平面。其結果是顯著增加的能力,聚焦束的穿透深度內的試樣中,頻繁的深度的范圍可以用激光共聚焦顯微鏡觀察到的兩到三倍之間。
正如前面所討論的,沿著光軸(z方向)的距離的四次方焦點區域以外的多光子吸收的概率下降。當與高數值孔徑的物鏡(1.4)進行多光子激發的熒光基團的均勻分布,約80%的吸收發生在一個嚴格定義的空間被稱為焦距的體積。本卷的尺寸依賴于物鏡的數值孔徑,但對于一個典型的的大光圈熒光在近紅外波長的目的,這被定義為一個具有橫向尺寸為0.3微米,直徑1微米的軸向長度的橢球區域。
漂白量的顯著減少(和相關的光損傷的細胞和組織)示于圖5(b)對于多光子顯微鏡基本上小于發生用激光共聚焦顯微鏡。漂白和光損傷的兩種熒光顯微鏡在研究中的活細胞,組織,和其他生物的最重要的限制。熒光的激發導致促進基態的電子激發單能量狀態。從激發態的振動弛豫過程中,有一個概率會發生系間竄越到三重態而不是典型的衰減的單峰態。三重態反應和相對長的壽命,它允許在此條件下的時間的熒光基團反應的活細胞或經過非熒光物種的分子變性或重排。此外,在三重態的激發熒光團可以產生單線態氧,這將相鄰的生物分子上的官能團與各種反應。必須激發光穿透標本焦平面上的焦點,大部分這種光過去的重點地區繼續傳播相當遠的距離。因此,人口穿過波束路徑的激發的熒光基團,為的是可在寬視場和激光共聚焦顯微鏡的情況下,將進行了相當數量的光,并產生細胞和組織損傷,可避免與多光子技術。
雖然暴露于光誘導的細胞損傷的確切機制了解甚少,已確定,光損傷降低將顯著擴展的可行性研究的生物樣品的熒光顯微鏡。暴露于長波長的可見光和近紅外光不影響細胞生存力,因此它很可能是與多光子顯微鏡的損害的大多數來自激發和被限制到焦平面。
多光子顯微鏡探測器
在多光子顯微鏡,通過二次熒光發射的光子的來源幾乎完全從物鏡焦平面,消除退掃描檢測的要求,并允許更靈活的檢測幾何。這種增加的通用性,可能會導致相當大的改進相比,激光共聚焦顯微鏡,熒光檢測效率。退掃描檢測在一個系統中,由物鏡收集的光反射到檢測器通過針孔之前,一系列的掃描反射鏡的表面的。共焦針孔的產生,同時提高圖像的分辨率,探測效率的下降幅度大時,必須采取的試樣的較長的曝光入射照明,光損傷的概率增加,光漂白。
在某些情況下,它可能是可取申請修改的多光子成像的共焦檢測技術(圖7)。入侵的室內光線下,可以排除通過使用一個大的共焦針孔,它可以產生橫向分辨率信號收集效率的成本略有增加。針孔也可以與小的入口孔,例如雪崩光電二極管或光電光譜儀檢測器的利用率。利用多光子成像針孔,應仔細檢查后方能實施。由樣品發出的光,可以向圖像形成的大部分將被阻塞的針孔。這既包括光散焦平面光源于重點區域界限內的位置。出于同樣的原因,也將是一個減少的量的熒光收集從試樣深處。事實上,當采用共聚焦針孔孔徑,增加試樣深處的信號衰減將是類似的多光子共聚焦成像。
幾種檢測圖案都在圖7中,示出了使用光電倍增管(光電倍增管),CCD圖像陣列檢測器和非光學檢測收集的熒光信息。光電倍增管檢測器給出在多光子熒光顯微鏡,有效地與這些設備可以被捕獲,因為發射波長較短(紫外線和低波長的可見光)。在圖7中的光電倍增管檢測器的各種標量之間的主要區別是是否發射的熒光被傳遞回通過掃描鏡(退掃描檢測)或通過中繼傳輸透鏡放置在一個平面上的共軛物鏡后孔徑檢測器(光電倍增管)。第三個光電倍增管(標有外部檢測器)所示的位置到右下的試樣,是用來捕捉從檢體不通過顯微鏡光學列車的任何部分的情況下,熒光直接。
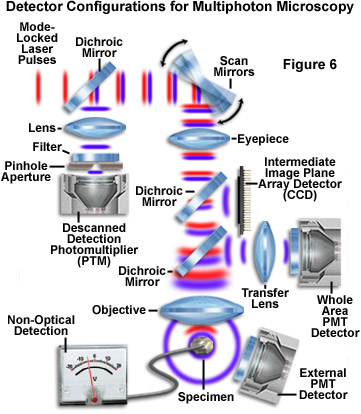
由于這一事實,分辨率定義為在多光子激發過程中,由激發的熒光基團發出的光可以被收集,而不使用物鏡。事實上,高數值孔徑的聚光鏡將足以應付累積二次熒光發射檢測器的目的。在某些情況下,光檢測器被放置高于(或低于,這取決于顯微鏡配置)試樣的區域中,從光學顯微鏡(圖7)中刪除。這種檢測方案,使短波發射,可能會受到影響,或因低傳輸通過物鏡的利用率。另一種策略是直接從附近的二色性反射鏡的反射光從通過轉換透鏡的后孔徑下的檢測器(如光電倍增管的整個區域,如上所述)中的物鏡收集排放。甲較短的排放路徑有利于收集光子的數目,特別是當通過沐浴在鹽水中的10到20微米的組織成像。雖然后一種方法中,可以采用熒光檢測效率最大化,它往往是容易污染室內光。
如電荷耦合器件(CCD)或互補金屬氧化物半導體(CMOS)探測器,光電二極管陣列,也可以被用來收集在多光子的實驗中(圖7)的熒光信息。在此配置中,由樣品發出的光被再次反射的分色鏡,并直接成像到光電二極管陣列的表面,這是放置在一個平面上共軛的中間像平面。因為分辨率由發射波長比激發波長較短,通常可以使用這種技術獲得的橫向分辨率的改善。
幾個非光學檢測方案有可能被應用到多光子顯微鏡,由于在激發過程中的高度的空間定位。其中,光電聲檢測,用來測量少量吸收,光化學掃描檢測,產生離子電流電壓鉗位細胞的受體分布的圖像。
在多光子顯微鏡的分辨率
多光子顯微鏡的分辨率不超過,實現了用激光共聚焦顯微鏡,事實上,利用較長的波長(紅色到近紅外,700?1200納米)的結果,在一個較大的點擴散函數的多光子激發。這轉化為橫向和軸向分辨率稍微降低。例如,使用的激發波長為700納米和130的數值孔徑的物鏡,所觀察到的橫向分辨率是約0.2微米與相應的軸向分辨率為0.6微米。當耦合到斯托克的偏移大小,這些值的范圍可以高達30%,大于在相同的條件下與傳統的共聚焦顯微鏡觀察到的分辨率。在實踐中,共聚焦分辨率有限針孔孔徑,色差,以及不完全對應的光學系統,所有這些都有助于減少共焦和多光子顯微鏡的分辨率的差異可能會降低。從這次討論中,很明顯,如果結構沒有得到充分解決,激光共聚焦顯微鏡,他們將不加價任何好轉(可能會加重病情)成像時多光子激發。
收集數字圖像或三維空間分辨率的光子進行計數,它是必不可少的區分的焦點,在后臺的體積內的熒光發射發生。兩個信號之間的分化可以通過工具(用共焦或者多光子儀器)或通過反卷積的三維數據集。的能力區分的焦平面和背景熒光的熒光發射信號背景比(S / B),其中,S的焦平面和乙收集的光子的數量或強度被定義為代表光子從背景(聚焦平面)。在激光共聚焦掃描顯微鏡,高S / B比值抑制背景信號所產生的共焦針孔。然而,在多光子激發,S / B比本質上是大的,因為很少有激發焦平面之外。多光子和激光共聚焦技術的分辨率之間的計算,可以比執行聚焦計算時考慮一個無限小的針孔。對于這兩種技術中,通常是幾個數量級大于經典的寬視場熒光顯微鏡的信號背景比。
還有一點要考慮的是,可以利用多光子激發熒光團在低波長紫外區的吸收轉換。因為低于約340納米的光激發熒光基團的能力是有限的共聚焦顯微鏡,研究者往往利用探針具有更長的波長,用相對較低的分辨率。在危急情況下,在多光子顯微鏡的分辨率可以提高,并且還通過利用諸如CCD的光電二極管陣列掃描影像中的平面下的空間分辨的檢測系統通過限制通過共焦針孔的成像波長。
激發特性的熒光基團
熒光小分子多光子實驗中應進行的用于單光子調查的相同標準來檢驗。探針應具有方便的波長,高的量子產率,低的光漂白率,和可能的最低程度的化學和光化學毒性大的吸收截面。熒光團也應該是無顯著退化,從所述激光源,能夠承受高強度的照明。在大多數情況下,研究者已經利用相同的公共熒光基團的雙光子作為標記在寬視場和激光共聚焦熒光顯微鏡,可廣泛用于實驗。
常見的熒光團的激發光譜的激勵模式和入射的光子的波長的函數。由于這種相依性,雙光子吸收光譜可以(而且常常)從相應的單光子光譜顯著不同。在實驗中,大部分已審查的熒光基團,能夠以兩倍于單光子的最大吸收波長的吸收雙光子激發。盡管如此,沒有根本的定量預測檢查單光子的截面簡單地通過一個復雜的熒光基團的雙光子激發光譜的基礎。高度共軛的非對稱的分子,這是經常被剝削分子光譜激發態的結構提供信息的單一和雙光子激發光譜之間往往存在顯著差異。一個很好的例子是芳香氨基酸衍生物酪氨酸和苯丙氨酸,其復雜的雙光子截面顯示單光子激發有很大的不同。與此相反,色氨酸(圖2)的雙光子光譜非常相似,顯示單光子激發的檔案。

定量三維重建的和去卷積實驗,光譜的熒光基團的雙光子吸收進行測量,以確保激發波長附近的吸收帶中的峰為中心。盡管雙光子的橫截面可以計算出,這個過程是復雜的最好的。直接的實驗測量的吸收光譜是優選的方法,但是這些實驗是困難的,因為少量的入射功率與在光源的強度波動吸收。熱透鏡效應,聲光技術已被用來確定吸收截面,但也許是一個簡單的方法,是研究光子發射與已知的量子產率的熒光團。當設計新的雙光子實驗時,應檢查的范圍內的熒光基團的二分之一的值,預期的激發波長附近具有吸收峰的。
圖7給出了測得的雙光子熒光激發光譜特性的一些常見的熒光基團。圖7中的數據代表的雙光子的動作,這是來自通過服用該產品的熒光發射量子效率和雙光子吸收截面的橫截面。記錄,可利用由鎖模鈦:藍寶石激光器射出的直線偏振光的光譜。黑點表示在每個光譜中,熒光基團的單光子的最大吸收的波長的兩倍。表1中是一個關鍵的兩個字母的名稱的代碼,在圖7中每個頻譜旁。曲線代表的熒光基團的雙光子激發光譜的橫截面。
熒光小分子的雙光子熒光激發譜
熒光名稱 | 激發波長 |
(BM) p-bis (o-methylstyryl) benzene | 691 |
(CB) Cascade Blue hydrazide trisodium salt | 750 |
(YL) Lucifer Yellow CH ammonium salt | 860 |
(BD - Bodipy) 4,4-difluoro-1,3,5,7,8-pentamethyl-4-bora-3a, 4a-diazaindacene-2,6-disulfonic acid disodium salt | 920 |
(DP - DAPI not DNA bound) 4',6-diamidino-2-phenylindole dihydrochloride | 700 |
(DN - Dansyl) 5-dimethylaminonaphthalene-1-sulfonyl hydrazine | 700 |
(PY) 1,2-bis-(1-pyrenedecanoyl)-sn-glycero-3-phosphocholine | 700 |
(CM) coumarin 307 | 776 |
(IC) indo-1 with Ca++ | 700 |
(IF) indo-1 without Ca++ | 700 |
(FC) fura-2 with Ca++ | 700 |
(FF) fura-2 without Ca++ | 720 |
(CG) Calcium Green-1 with Ca++ | 725 |
(CO) Calcium Orange with Ca++ | 800 |
(CC) Calcium Crimson with Ca++ | 850 |
(F3) fluo-3 with Ca++ | 800 |
表1
橫截面的測量表明,雙光子吸收的激發峰是非常類似的,相對于單光子的檔案中(圖7)或藍移的趨勢。可能是有利的耦合可用鎖模激光器的波長范圍內的熒光團激發的平均波長較短的。雙光子吸收光譜的另一個方面一致的是,他們通常更廣泛的比單光子。這簡化了實驗的約束通過增加適合激發的和增強的能力,同時激發兩個熒光基團,有重疊的雙光子的橫截面,但廣泛分離單光子光譜的波長范圍內。三光子橫截面的測量表明它們是在一般情況下,相應的單光子光譜非常相似。
雖然吸收光譜往往不同于單光子和雙光子激發的熒光特性,以及其他如壽命,發射波長,和系間竄越速率似乎并沒有受到影響。表示線性或非線性吸收達到相同的熒光激發態,并且一旦被激發的熒光基團,它的行為激勵模式一樣的,不管這樣的相似性。這些租戶還持有三光子激發,讓研究者利用既定的比例和光譜方法在大多數的多光子實驗。
照片和熱損傷的多光子激發
所有形式的熒光顯微鏡遭受光損傷活細胞,其程度是依賴于激發波長,曝光長度,和用作蜂窩探針的熒光基團的化學性質。激發照明的損傷,可以劃分為兩大類:由于化學反應的熱破壞和退化。光化學的副作用引起的生化反應,作為熒光團激發的結果,沒有得到很好的理解,細胞和組織類型之間差異很大。另一方面,產生的熱損傷,主要的兩種機制,因為借著水和在在焦區的熒光基團的雙光子吸收的單光子吸收發生。
在大多數研究的細胞(特別是哺乳動物細胞中),幾乎不存在固有的熒光基團,利用多光子熒光吸收長波長的近紅外激發輻射。然而,周圍的細胞和組織中的細胞內和細胞間的水能夠吸收紅外和近紅外照明的顯著量的,產生多余的熱量,有可能損害生物標本的可行性。另一方面,當含水的生物環境照明的可見光和紫外光的波長較短的共聚焦和寬視場熒光顯微鏡,顯著量的熱利用周圍的水不被吸收。
的暖氣由于單光子吸收,可水沿束路徑的上方和下方的焦平面發生。控制平均的多條件下,已計算引起的溫度上升,分別在700和1000納米,介于0.065和1.1攝氏度。這些協議在1064納米光鑷激光激發的熱量進行測量計算。激動人心的光束被固定的情況下,可能會發生更大的加熱,隨著時間的推移對數關系在迅速上升。暖氣,由于熒光吸收高度本地化的多光子激發實驗的震源區。隨后的熱釋放內均勻發生一個球對稱周邊地區的焦點體積,并沒有產生顯著的熱量,即使是在高濃度的熒光。
結論
多光子熒光顯微鏡是變給出一種方法,用于活細胞和組織的動態成像。該技術是特別有用的紫外線激發不會以其他方式是可能的,因為光學系統的光透射特性的生物系統。此外,在多光子激發的副作用,如漂白和光損傷最小化,并且只發生在立即周邊地區的焦點體積。雖然預測和測量雙光子吸收型材共同熒光正在慢慢地實現,這方面工作的一個顯著量的留下來完成的。設計新的針對多光子激發熒光團仍然處于萌芽階段,但應該沿著這條大道預計在未來幾年取得了一些進展。
光毒性的細胞是一個知之甚少的現象,但不發生很大程度在大多數形式的熒光顯微鏡。較低的量子能量和較低的本征吸收較長的波長,利用多光子顯微鏡有助于減少光的有害影響活細胞和組織,細胞動力學開放的大門,新的調查。多光子顯微鏡研究中的一個主要障礙是設備成本高,尤其是必要的鎖模脈沖激光雙光子和三光子激發所需要的系統。超快激光系統普遍使用的兩種主要類型是鈦:藍寶石和Nd:YLF激光器,這雖然是非常昂貴的,并不需要水冷卻,也沒有過多的電力需求。在Ti:藍寶石脈沖激光(700至1100納米)的波長可調諧性,使其更為靈活比單波長的Nd:YLF激光器(1047納米),但方便排除手動操作的總的可調諧性。隨著新的,更便宜,用戶友好的激光引入一個競爭激烈的市場,更多的商業的多光子顯微鏡系統將推出一個更便宜的價格。這種情況,再加上多光子熒光的實施,有沒有物理限制的事實,將鼓勵整個生物科學的廣泛應用這項技術。



