尼康顯微鏡:活細胞成像的光學系統和探測器的要求
在活細胞的調查設計的光學顯微系統時,主要考慮因素是檢測器的靈敏度(信號 - 噪聲),所需要的圖像采集速度,和標本的可行性。相對較高的光強度和較長的曝光時間,通常采用在記錄圖像固定的細胞和組織(如漂白為主要考慮因素),必須嚴格避免工作時,與活細胞。在幾乎所有的情況下,活細胞顯微鏡代表實現*佳的圖像質量,并保持健康的細胞之間的一種折衷。不必要的采樣時間點,使細胞過度的照明水平,而不是實驗設置的時空分辨率應限于調查的物鏡相匹配。
原則上,理想的活細胞圖像采集系統是不夠敏感,從弱熒光標本,同時記錄所有動態過程足夠快取得優異的圖像。此外,該系統將有足夠的分辨率,捕捉*細微的標本細節和寬動態范圍,能夠準確測量非常微小差別強度。不幸的是,這些條件中的任何一個優化僅在犧牲其他實現。因此,目前不可能設計一個通用的活細胞成像系統,這將是非常可能的調查范圍為整個。相反,研究者必須妥協,確定*重要的參數進行優化,同時仍試圖限制那些被認為不太感興趣的變量所作的犧牲。顯微鏡配置中底,*終決定于所涉及的攝像模式(次),在實驗過程中,標簽協議的難易程度,和可用的設備保持試樣活力的必需品的要求。
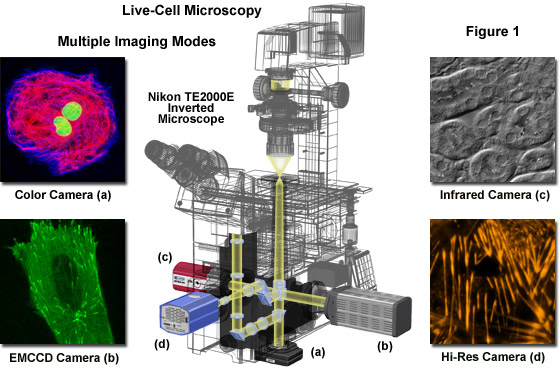
圖1中顯示的是現代倒究級組織培養顯微鏡配備4的攝像頭的端口,每個端口耦合到一個不同的為特定的成像模式下的攝像頭設計。在大多數情況下,這種設計直接為100%的光到一個端口(一個端口上進行一次),顯微鏡或分割光相機之間的港口和目鏡80:20。對于在低光照水平的關鍵成像,研究者應當確保*敏感的攝像機連接到一個端口接收由樣品發射的光100%。在圖1中,全彩色CCD攝像機的港口底部(一)接收來自物鏡的光不反射的反射鏡或棱鏡,并在這種情況下,采用圖像乘以在明視場模式下的標記的熒光的樣本(或染色標本) 。高性能電子數字乘以(EMCCD)相機(B)連接到右側端口的使用,表現出非常低的水平的熒光圖像標本。微分干涉對比成像深入厚的組織的紅外光,具有傳感器的相機((三);左側端口))與在700納米和1000納米之間的高量子效率是必要的。*后,對于高分辨率的單色成像通過全內反射和其他熒光技術,珀耳帖冷卻的相機((四),前端口)與相對較小的像素(6微米)是理想的。的配置,例如在圖1中所示的是昂貴的,但可以是非常通用的核心成像設施。
使用了廣泛的對比增強成像模式,在光學顯微鏡進行活細胞成像。調查的大多數涉及某種形式的熒光顯微鏡,通常耦合到一個或多個透射光技術。熒光技術包括傳統的廣角落射熒光,激光掃描共聚焦,旋轉盤橫掃場共聚焦,多光子,全內反射(TIRF),熒光相關光譜,壽命成像(FLIM),光敏,激光捕獲。作為一個子集,專門的成像方法,如多色成像光譜成像,共存,時間推移序列,漂白恢復技術(FRAP,FLIP,FLAP),共振能量轉移(FRET),斑點顯微鏡(FSM),膜片鉗往往是耦合到一個或多個主要成像模式。可以補充傳統的明視場模式下,包括微分干涉相差(DIC),霍夫曼調制對比度(HMC),相位相反的熒光技術,作為熒光探針本地化的確認。在幾乎所有情況下,每個的顯微鏡配置需要一些**的考慮,必須實現成功的活細胞成像。不管顯微鏡和數碼相機系統成像的活細胞和組織中,兩個*重要的限制因素是維持細胞生存力和實現可能的*高信號電平,背景噪聲和自體熒光。
優化信號噪聲活細胞成像
固定和活細胞成像的根本區別在于,前者的研究者提供了充足的緯度定義圖像采集參數,如找到合適的視場,并確定曝光時間,以及調整電子增益設置,讀出率,和偏移值。在大多數情況下,其結果是,它是可以(與充分染色固定的標本)收購利用的照相機系統的整個動態范圍的圖像,從而產生*佳的信號噪聲比。不幸的是,情況是不同的活細胞成像參數上的限制所施加的嚴格要求保持細胞活力。常常活細胞與獲得的圖像中,試樣的強度只有少數幾個灰度級高于背景。在這種情況下,*重要的成像代價變成暗電流和讀出噪聲水平的檢測器系統。經濟的相機通常具有更高的噪音水平,從而導致不太均勻的背景圖像,從檢體的信號,越來越嚴重的讀出速度增加的效果,即經常掩蓋。在幾乎所有活細胞成像應用中,探測器的選擇是至關重要的,在確定一個實驗的成功或失敗。
檢測器產生的噪聲在數字成像中的四個主要來源,泊松或拍攝噪聲(由于隨機性質的光子通量)和雜散光的照明系統。在大多數情況下,系統地降低噪聲,可以通過仔細選擇的檢測器和優化的照明條件。幾乎每一種類型的光子探測器到每個測量記錄與設備引入某種形式的噪聲。在激光掃描和多光子顯微鏡使用的光電倍增管內產生雜散的電子信號放大系統。同樣,電荷耦合器件(CCD等),利用寬視場,反褶積,全內反射,旋轉盤,和掃掠字段顯微鏡表現出與每個像素相關聯的背景暗電流。在CCD和光電倍增管設計的改進,包括冷卻裝置,以非常低的溫度,減少了暗電流的貢獻,以非常低的水平。然而,特別是在讀取每個像素的CCD的情況下,將模擬信號轉換成數字相當于貢獻了額外的噪聲分量被稱為讀出噪聲,在當前一代的冷卻的數碼相機系統的主要噪聲偽 影。

圖2所示是相互依存的活細胞成像的讀出速度和圖像質量的數碼相機的靈敏度。標本是一種文化的單體Kusabira橙(MKO)熒光蛋白和人α -微管蛋白TRITC濾波器組合廣角成像熒光照明和灰度攝像系統操作的讀出速度的融合表達的宮頸癌細胞(HeLa細胞線)10或1.25百兆。當相機的CCD被關閉了(不接收光),背景噪聲顯著降低時,讀出速度慢時,描繪在圖2(a)和2(二)分別為10和1.25兆赫的速度,。這種差異不嚴重影響相機的性能時的曝光時間可以調整,以利用整個動態范圍,就證明了類似的在圖2(c)和圖2(d)的圖像質量。然而,在低光照條件下,讀出速度較慢(圖2(f))提供了優異的圖像質量。圖2(e)和2(六)中的圖像被捕獲在約低10倍的光強度比與圖2(c)和圖2(d)。降低照明度另一個5倍,產生的效果表現得更為明顯,如示于圖2(g)和第2(h),其中的讀出速度較慢,提供了一個勉強可以接受的圖像(圖2(小時)),同時快速讀出模式(圖2(g))沒有。
一個成功的數字成像實驗需要在整個視場和連續圖像之間的空間照明模式標本是恒定的。根據不同的照明源,通常橫跨試樣字段的光學性能是相當恒定的(稱為空間不變性)在顯微鏡使用鎢鹵素燈。然而,在激光掃描顯微鏡中,傳送到一個特定的像素的照射劑量可以為每個掃描變化。此外,汞等離子弧放電燈源一般采用在寬視場熒光顯微鏡不提供均勻強度的整個頻譜,而是產生離散的特定波長的高強度的峰。氙氣燈,與此相反,在可見光譜范圍內表現出一個更為均勻分布的強度分布圖,但缺乏在紫外區(通常避免在活細胞成像的照明范圍)。
組合弧放電燈(例如,金屬鹵化物燈),具有的屬性之間的中間汞和氙氣的混合物,顯示出除了提供連續光譜從紫外到紅外的也許是*好的特性,這兩個物種**的汞線。無論光源,照明場可以呈現幾乎均勻放置燈箱和顯微鏡的光學列車照明輸入端口之間的光纖(或液體光導)。然后可以使用平場算法計算糾正任何剩余的照明梯度視。重要的是要注意,燈的輸出功率的時間變化,它可以改變從平均10%,未校正光纖,需要一個穩定的電源的應用。
光子通量的測量本質上是一個統計過程中,與信號檢測的不確定性因素。稱為泊松或散粒噪聲(如上所述),凈效應是,對于N個光子的測量的不確定性等于?,這也是的信號-噪聲比的平方根。*大化的信號的光子數(N)直接導致在信號與噪聲和圖像對比度的改進。提高信號的*簡單的方法是收集更多的光子,通常采取長時間曝光或激發照明水平不斷提高,但這些措施還可以增加光毒性和妥協細胞活力。甲第二,也許更有用的替代方案,以提高探測器的靈敏度。
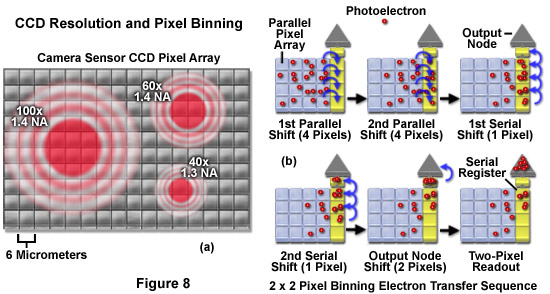
為了克服低光照水平與活細胞成像,現代數字CCD相機可以配置稱為分級(詳見圖3和圖8)實施過程提供一個顯著的敏感性增加。在正常讀出的量傳輸到讀取寄存器中,然后將其按順序分析的水平像素行中的像素的CCD。在離散化的圖像,從圖像傳感器上的一組相鄰的像素(例如,一個2×2或4×4塊)相結合的信號(光電子),并分配到一個單一的像素值的讀出數組中。這是通過轉移到串行讀寄存器(例如,兩排為2×2像素合并4×4像素合并和四行)的多個平行的行的像素,然后讀取組2,3,或多個像素一起。在2×2像素合并的情況下,有兩倍的分辨率損失,信號增加了四倍,和2倍的改善信號對噪聲。顯然,改善信號限定的應用程序可以是顯著的,雖然上面的空間分辨率的成本。

圖3示出了使用水平的不斷提高分箱相結合的相鄰像素的空間分辨率和拍攝的數字圖像的*終尺寸的影響。的試樣是培養赤麂鹿皮膚成纖維細胞表達的融合mCherry熒光蛋白(紅色pseudocolored)和人的β -肌動蛋白,它定位于,包括的絲狀細胞骨架網絡的應力纖維。如與熒光蛋白標簽,通常觀察到的細胞,顯示高定位精度往往是那些表達的融合產物,在很低的水平,顯著降低了可用的信號。由于沒有分級啟用(圖3(a)),信號過低時產生的曝光時間可以忽略不計的光毒性和光漂白區分。離散化2×2和4×4的逐漸增大的信號電平,但在成本,空間分辨率(圖3(b)和圖3(c))。*亮的圖像是由離散化的8×8像素(圖3(四)),但遭受急劇的分辨率的損失。很重要的一點要注意的是,圖像的尺寸按比例下跌增加結合在分級過程中的像素數量。例如,在圖3中未像素合并(1×1)的圖像本來是1360×1024像素,而(2×2),(4×4)和(8×8)離散化的圖像是680×512,340所述256,和170×128像素。為說明的目的在圖中,這些圖像已經被縮小尺寸。同樣,一臺數碼相機,具有512×512的顯示尺寸,以類似的方式離散化時,產生256×256,128×128和64×64像素的圖像。
在分級的概念的一個關鍵點是,除了讀出噪聲分級過程后發生,因此,即使幾個像素結合,只有一個讀取事件每合并像素。與此相反,如果一個2×2像素框中,然后計算平均數據收集后,其結果將是不如分箱,因為由四個像素中的每一個的單獨的讀出噪聲的貢獻。因此,盡管分級犧牲空間分辨率,但一個顯著增加,導致信號噪聲比,一個特別有用的優勢進行實驗時,要求低光照水平和較短的曝光時間上的光敏細胞。在活細胞成像的關鍵參數通常是能夠探測到微弱的熒光信號,而不是空間來解決這些問題,所以圖像的力度和速度的增加收購所帶來分級*過抵消分辨率的損失。作為一種替代分級,許多高性能相機使研究者通過閱讀只有一個子數組或完整的CCD陣列,一個有用的機制,以保持空間分辨率的同時,減少了大量的利息選定區域,以減少圖像采集時間時間細胞暴露于有害的照明。
為了克服傳統的高性能CCD相機的應用需求快速幀速率捕捉在極低的光照水平的缺點,放大微弱信號以上的CCD讀出噪聲地板廠商都推出了一個創新的方法。通過將一個片上的乘法增益寄存器,電子倍增的設備(EMCCDs)實現典型的強化或電子轟擊CCD的單光子的檢測靈敏度,在低得多的成本,而不會影響傳統的CCD結構的量子效率和分辨率特性。EMCCDs的顯著特點是將產生倍增增益硅子結構(參見圖4)內通過的過程中,碰撞電離在傳感器芯片上的一個專門的擴展串行寄存器。高于的光子產生的電荷的讀出噪聲,即使在高幀速率,并適用于任何當前CCD傳感器的配置,包括背照式設備。
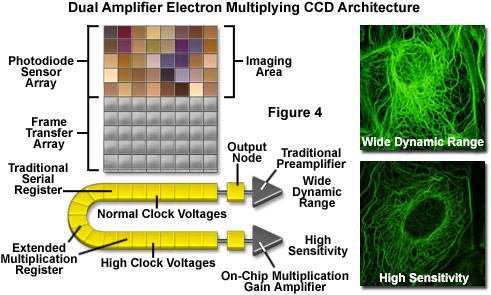
甲EMCCD相機系統的顯著優點是,它們是大大減少制造成本加劇的CCD相比,由于直接結合到CCD結構的信號的放大級。對于重要的活細胞與低強度的信號,如單分子成像中所遇到的,全內反射,旋轉盤和掃掠字段共聚焦顯微鏡,鈣離子或其它離子通量的測定,時間分辨三維顯微鏡調查EMCCD提供其他傳感器專為低信號水平的顯著優勢。此外,與傳統的熒光成像技術的較高的信號電平時,EMCCD系統的極端敏感性,允許較低的熒光基團的濃度和/或降低來自激勵源的功率電平的應用,因此,可降低光毒性和光漂白的熒光探針。
顯微鏡的光學系統
針對活細胞成像應用的顯微鏡都必須配備一個高品質的框架構造堅固的復合材料或鋁及應穩定牢固地安裝在無振動平臺。外部光的表面以及模塊外殼(聚光鏡,燈箱,物鏡轉盤等)應保持干凈的狀態和周圍環境的顯微鏡應無粉塵和相對濕度較低。在持續所需的活細胞成像的例行程序,以確保使用科勒照明的原則對準顯微鏡的光學路徑和隔膜。實驗室房間殼體顯微鏡受益的能力,以減少所有開銷照明,以減少的雜散光進入通過目鏡的顯微鏡或樣品室的水平。
電子數碼相機系統通常安裝到顯微鏡體通過一個或多個相機使用專門的適配器端口。研究級顯微鏡通常配備多個端口,使連接幾臺攝像機同時進行(見圖1)。尼康顯微鏡,采用多種成像模式,使相機的優化配置,為每個對比度增強技術,可以快速訪問,必要時,此功能特別有用。身體內的顯微鏡,反射鏡,分束鏡,棱鏡級聯策略性定位,以反映圖像形成光波相機的各種端口和目鏡。重要的是要注意,任何圖像采集期間發送到目鏡的光這樣做上面的費用發送到照相機的光,因而降低了信號 - 噪聲電平。因此,配備顯微鏡,口方向控制應調整到100%的光傳送到相機端口用于收購光子熒光圖像有限。
物鏡的選擇是至關重要的,從檢體收集的*大信號,并將其傳送到顯微鏡的光學列車。在光路中,如鏡,分光鏡,投影鏡片,過濾器和棱鏡的元素數量過多會嚴重的降低拍攝的圖像信號噪音水平必須保持在**低。在熒光成像中,具有非常高的數值孔徑的物鏡需要從檢體收集的光的量*大化。數值孔徑,它定義了多少光線可以從單點源收集的鏡頭,可以說是*重要的考慮因素,在選擇物鏡為活細胞成像。這個值是刻在物鏡桶和范圍從0.25低倍率(10倍)干油浸版本(通過100倍40倍)物鏡為1.20和1.45。在數學方面,數值孔徑表示為:
數值孔徑(NA)=折光指數(η)×鏡頭接受角(Sin(θ))
因此,物鏡的聚光能力的前透鏡之間的介質,能夠有助于*大限度衍射光線的角度的正弦值(θ)乘以試樣的折射率(η)是由圖像形成。此外,產生的圖像的分辨率由物鏡的數值孔徑的函數。根據瑞利判據的(保守估計),分辨率是相等的照明的波長和物鏡的數值孔徑除以乘以一個常數(0.61)。此外,數值孔徑定義的強度(亮度)的圖像,這是與數值孔徑的四次方成比例,但只成反比的放大倍率的第二功率。因此,小數值孔徑的增加,可以產生顯著改善的信號。出于這個原因,活細胞熒光成像,通常需要*高的數值孔徑物鏡耦合到高折射率的浸沒介質(油或水)。
正如上面所討論的信號的亮度的物鏡放大倍率的平方成反比,從而使較低倍物鏡往往是有益的,當昏暗的樣品成像。例如,如果信號-to-noise比成為與100x物鏡的數值孔徑1.4,改變到一個類似的數值孔徑,將提供一個顯著的改善的亮度的60倍或40倍的物鏡成像的標本中的限制因素。事實上,一個特定的熒光功能成像時出現幾乎3倍的亮度與60倍與100倍的物鏡(數值孔徑為1.4)。所觀察到的強度也是一個函數,對傳輸質量的變化的物鏡,它始終是值得考慮的放大倍數和像素合并在一起,以評估一個特定的實驗所需的*終放大倍數。
用于成像多重標記的固定細胞(和在某些情況下,活細胞),良好地校正色差的整個可見光譜范圍(包括從400到700納米;稱為apochromats),具有平坦的成像平面(簡稱物鏡平場或PLan)被認為是理想的。不幸的是,復消色差和復消色差計劃的物鏡,以及那些用來捕捉更廣闊的視場,不可避免地含有多個光學元件(鏡片)比不太精確的物鏡(消色差透鏡和螢石)。矯正度數高,使這些物鏡用于透射光技術,用*少的文物包括相襯和DIC。然而,結果是,光吞吐量犧牲*佳的光學矯正,因此有固定細胞成像效果不大,但在活細胞成像往往適得其反。此不足之處是*好的證明了一個事實,即平場復消色差高數值孔徑為1.4,這在理論上應該比類似100x物鏡亮約6倍,40倍的物鏡是在實踐中,只有約4倍,明亮。無論如何,40倍和60倍的物鏡仍然提供*亮的圖像,可以實現在光學分辨率的極限。
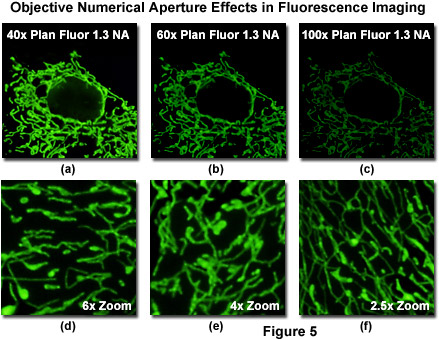
圖5中所示的數值孔徑的原理的分辨率和圖像的亮度方面的重要性的一個例子。樣品是培養貼壁的非洲綠猴腎上皮細胞(CV-1行)的質粒載體轉染編碼增強型綠色熒光蛋白融合到線粒體靶向的核苷酸序列從人類細胞色素C氧化酶亞基VIII。的質粒轉染的哺乳動物宿主的轉錄和翻譯后的線粒體定位信號是負責細胞線粒體網絡的熒光蛋白嵌合體在整個運輸和分配。管狀線粒體隨后可以可視化使用熒光顯微鏡。
在圖5中,使用具有相同的光學校正(方案螢石)和數值孔徑(1.3)的物鏡成像的相同的視場,但與從40倍到100倍的放大倍率。盡管像素的數目和檢測器的條件下,利用在圖5中收集的圖像是相同的,線粒體是明亮的成像時,通過40倍物鏡(圖5(a),注意,圖像已被調整到一個共同的大小)。相比之下,更高的放大倍率60X和100X的物鏡(圖5(b)和圖5(c),分別為),100倍的圖像幾乎不產生逐漸變暗的圖像。此物鏡,仍然可以使用的圖像試樣,但檢測器的增益,必須顯著增加,導致惡化的信號 - 噪聲比,并通常次于圖像。請注意,物鏡的分辨能力(圖5(d)到第5(f))是可比較的,因為在相同的數值孔徑值。
從圖5中的數據,將收集到的基本概念之一,是為了避免過度放大時,選擇物鏡為活細胞成像熒光蛋白(和其他的熒光團,為此事)。簡單地增加數字放大(變焦)在共聚焦顯微鏡圖像采集,圖像大小相當于100倍的鏡頭(圖5(D)和5(e))的40倍或60倍的物鏡結果。這兩個物鏡的分辨率是一樣的,因為他們有相同的數值孔徑值。不應被視為相對次要的放大倍率參數表明,使用60倍或100倍的物鏡是不是有利。事實上,選擇高倍率的物鏡通常是必要的,當使用寬視場顯微鏡的成像非常小的物體,如過氧化物酶體或分泌顆粒,。由于圖像的大小相對于檢測器尺寸起著重要的作用,在確定空間的采樣頻率,確定的*佳放大倍率的數字照相機系統(CCD像素的大小和中間倍率)的參數。因此,物鏡的*佳選擇通常取決于儀器的光學結構的,除了一個特定的實驗的具體要求。
在情況下,信號噪聲比分辨率更重要,它往往是一個更好的選擇,利用下校正(更少的光學元件)具有顯著更高的光吞吐量物鏡。時,應注意也可用于通過包含顯著降低光透射的光學元件,如相襯物鏡的振幅降低板的物鏡的成像。這種光的減少的電平是很少的傳輸模式中的一個問題,但可以顯著減少在熒光成像的信號電平(由15%至20%)。出于這個原因,階段物鏡不應該被用于活細胞成像,低豐度的探頭,除非實驗的協議需要相襯和熒光圖像的疊加。同樣,當組合使用熒光和DIC圖像正在收集,偏振光儀(約30%)降低了信號通常是放置在共享的光路正下方物鏡和獲取熒光圖像前應除去。
在光學顯微鏡的列車存在的任何缺陷會影響*終圖像中的信號噪聲比。在活細胞成像與高數值孔徑物鏡,球面像差是*常見的神器,必須加以克服。此像差產生從洗澡的細胞(通常的折射率為1.33的水溶液)和物鏡液浸介質的折射率的介質之間的不匹配。球面像差通常表現為不均勻的傳播使得顯著伸長,扭曲的圖像的一個點沿著光軸的焦點。因為該信號被分布在一個更大的體積中存在的像差,信號 - 噪聲比降低。此問題是更嚴重的進深比它厚的組織與蓋玻片(通常只有幾微米厚)上的貼壁細胞,可以在很大程度上消除了使用的水是更緊密匹配的折射率的浸沒透鏡成像時培養基中。作為替代方案,浸沒介質的折射率或蓋玻片的厚度可以調整。重要的是要注意,折射率隨溫度的變化,因此,液浸介質的*佳組合和蓋玻片的厚度會有所不同在室溫至37度攝氏。較新的浸沒物鏡校正鋌可以用來對抗由溫度引起的折射率的波動。

圖6給出了顯微鏡的光學系統(圖(a))和檢測器(數碼相機,圖(b))進行活細胞的調查是顯著的局限性。的檢體是由一個單一的間期核粘附袋鼠大鼠腎上皮細胞(PTK2線)表達增強型綠色熒光蛋白(EGFP)的稠合的組蛋白H2B序列(定位在細胞核中),在寬視場熒光成像與外延照明。的*高分辨率的圖像的右上角的下面板(一)中的光學系統,并在較低的左上角的圖(b)中的數字照相機系統。在活細胞的顯微鏡,光學系統確定可用于對比的產生,以及規定的物理分辨率的限制,這是由物鏡的數值孔徑和波長的照明的光的數量。隨著照度增加(運行在面板(一)從頂部到底部),在光子計數噪聲變得不那么明顯和圖像質量的顯著提高。同樣,作為增加光學分辨率(左到右面板(一)),的細胞核中的更小的細節變得更加顯而易見。
數字攝像系統的捕獲數據根據離散的光照水平和空間分辨率元素(圖(b),圖6)從顯微鏡和樣品的光信息。由于像素尺寸的增大(左到右面板(B)),許多功能的小細節變得模糊和圖像獲取塊狀,外觀幾乎不(在面板的右下角的角落(b)條)。減少用來捕捉并顯示圖像(底部到頂部面板(B))的灰度級的數量減少遮光,只留下功能,具有非常高的對比度面板(B)(上排)。請注意,這兩個因素共同提供信息。再次,在活細胞成像實驗中,收集的信息的量應該是調查的要求成比例。
各種過濾器和鏡子,專為活細胞成像顯微鏡直接和微調照明和發射光的波長的檔案,因為它從光源通過顯微鏡(標本),然后探測器。與對比度增強的光學系統在傳輸模式下,改性光組件的任一偏振器,棱鏡(DIC)或聚光鏡的環形通道和相位環(相襯和Hoffman調制對比度)。成像時,在這些模式中,由于用于明場,DIC顯微鏡光學列車,相位相反的光的整體吞吐量遠遠高于熒光,很小的修改通常是必要的,以增加信號噪聲。主要考慮的是過濾鎢鹵素燈照明,以消除光毒性的紫外線和紅外線的波長才損壞試樣。阻擋紅外光,是必要的,以避免熱損傷的細胞,并減少復雜紅外敏感的攝像系統的信號 - 噪聲與背景水平。紫外線光少的關注與透射光燈,但使用綠色或紅色的干涉濾光器,可以很容易地控制試樣的波長達到。無論是紅外光與可見光過濾器將顯著減少光的水平,并可能需要增加曝光和增益的設置,以保持信號與噪聲的檢測器系統。
在熒光成像,干涉濾光片和二色性反射鏡相結合,以選擇適當的波長頻帶的光用于激勵從熒光團標記的樣品收集排放。光水平相對較低時相比,傳輸模式,在熒光顯微鏡中,呈現為實現足夠的信號的噪聲電平的關鍵的選擇的過濾器。在大多數情況下,特別是在信號的放氣,通過關注的問題是,由于重疊的熒光團發射的檔案,帶通激發和發射(阻擋)過濾器的應用是必需的。通常情況下,這些過濾器中所固有的窄的光譜窗口進一步限制通過的光量通過顯微鏡觀察,挑戰研究者為獲得滿意的圖像,來選擇*佳的帶寬。
顯微鏡制造商和售后的光學過濾器公司都可以從各種各樣的具體的帶通濾波器和二色鏡組合。為了獲得*佳的噪聲信號,為活細胞成像的選擇過濾器組合應密切配合在實驗中使用的熒光光譜。例如,使用一個標準的熒光素(FITC)過濾器集的圖像細胞表達黃色熒光蛋白(YFP)本身造成不必要的犧牲一些YFP的熒光,否則將改善的信號噪聲(多色標簽的應用設計參見圖7(a))。在這種情況下,匹配的配置文件與相應的寬的帶通激發YFP的吸收光譜和發射濾波器耦合到一個長通發射濾光片產生顯著較高的信號。
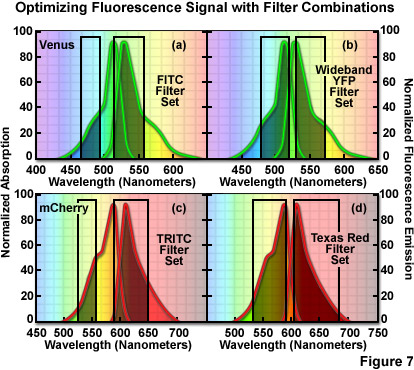
在兩種流行的熒光蛋白的衍生物,在圖7中,例如,的優化熒光的過濾器的組合,以獲得盡可能高的信號電平的。頂部面板(圖7(a)和圖7(b))示出金星的吸收和發射光譜,位點定向誘變YFP的產品,疊加在FITC標記的過濾器設置(圖圖7(a)),以及一個專門的寬帶組合旨在*大限度地采集到的信號,在一般情況下,從黃色熒光蛋白(圖7(b))。雖然排放過濾器與問候到檢測器發送的信號的電平相媲美,金星的吸收光譜和異硫氰酸熒光素的激發光濾光片帶通區域是顯著小于所觀察到的與寬帶YFP的集之間的重疊,從而導致低效的激勵和減少信號。同樣地,一個TRITC過濾器的組合(圖圖7(c))不激發mCherry熒光蛋白的效率,因為德州紅組(圖7(四))。此外,在得克薩斯紅組合的發射過濾器的更寬的帶寬傳遞到檢測器上的多個信號。選定的過濾器組合方面,應仔細審查每一個活細胞成像實驗中使用熒光激發和發射,以確保*高的效率。
除了標準的過濾器的組合設計單個熒光圖像,多波段集現在隨時提供給能夠同時與兩個或兩個以上的熒光探針標記的試樣的照明和探測。其他因素時,必須考慮微調顯微鏡的光學列車是中性密度濾光片,以減少激發照度水平(活細胞熒光成像的關鍵),以及紫外線和紅外線過濾器,以抵消或消除試樣的光毒性的戰略定位。這些過濾器通常放在照明源之間的電弧放電(或激光),并在顯微鏡的輸入光端口,并且可以很容易地互換,以優化的光通過。的強度和光通過顯微鏡的數值孔徑也可以通過仔細調整聚光鏡或落射照明孔徑和視場光闌調節。
探測器的幾何形狀匹配光學分辨率
由檢測器系統的光學圖象有足夠的采樣,在顯微鏡拍攝的圖像的空間分辨率通常被定義的光學系統的分辨率。因為CCD探測器構成的各個像素的幾何形狀可以從陣列中的光電二極管,每一個具有一個固定的大小,限制了*終圖像的分辨率。為了實現充分顯微鏡的分辨能力,檢測器的尺寸應符合每個艾里斑單元為2.5?3像素的奈奎斯特采樣準則。作為一個例子,對于250納米的光學分辨率極限,在*終圖像中的像素大小應是約80至100納米。在活細胞成像,信號噪聲比光學分辨率往往是更關鍵的,*有用的限制用于收集圖像沒有明顯的降解是每2個像素艾里。的每個艾里單元的像素的數量減少,增加了圖像的亮度,并允許使用更大的CCD的光電二極管,可以積累更多的光電子。
圖8所示的(一)的圖像投射到CCD像素陣列的表面活細胞成像中普遍使用的高數值孔徑物鏡的艾里磁盤。在陣列中的每個像素的大小是6微米。100x物鏡的數值孔徑為1.4,將圖像投影到CCD表面的直徑是20微米的(見表1),從而很容易實現的奈奎斯特采樣大小(3.3像素每個艾里單元)。在本次抽檢頻率,足夠的保證金,幾乎滿足2×2像素binning奈奎斯特準則。與此相反,60倍的物鏡(1.4數值孔徑)投影圖像的直徑是12微米,僅低于奈奎斯特限制的下邊界。此外,即使具有減小的數值孔徑為1.3,在40倍物鏡產生一個8.4微米的圖像,將需要一個放大鏡照相機適配器,以符合奈奎斯特分辨率標準。光電二極管陣列具有更大或更小的像素尺寸相匹配的光學顯微鏡的分辨率,無需中間放大倍率或一個專門的CCD攝像頭,包含合適的鏡頭系統,可以輕松地修改。
2×2像素binning示意圖如圖8(b)對于一個數組,包含16個像素。的光電子在曝光期間積累后,相機讀出電路執行兩個連續的每4個像素的平行移動。隨后,兩個串行移位寄存器的1個像素的地方收集的4個像素(2×2像素合并)到它們的電壓讀出放大器的輸出節點的光電子。4×4像素合并(圖中未示出),以類似的方式,在整個16個象素陣列的內容轉移到輸出節點,在讀出之前,顯著地增加了,同時減少了讀出噪聲信號。如前所述,像素binning是一個很好的方法來檢索微弱信號時,檢查熒光蛋白標記的活標本,在低表達必要的水平,以減少毒性文物。
在實踐中,理想的具有1.4的數值孔徑的一個物鏡的在*終圖像中的像素尺寸在100和120納米之間。這個數字翻譯成適當的物理尺寸CCD光電二極管,需要考慮物鏡的放大倍率。例如,要實現充分的光學分辨率為60倍的物鏡(1.4數值孔徑)的檢測器必須具有一個光電二極管6微米或更小的大小(所確定的放大倍率和分辨率的商品)。然而,對于一個100x物鏡的數值孔徑相同,*佳的光電二極管的面積增加至10微米。因此,顯而易見的是,一個特定的CCD攝像機的數字分辨率只匹配顯微鏡的光學分辨率的相機時,適當地耦合到適當的物鏡。交配的CCD攝像機具有10微米的光電二極管,以100倍的物鏡,將導致在*后的像素大小為100納米的圖像。同樣的相機,將產生167納米的像素,使用時用60倍的物鏡,這就限制了有些記錄圖像的分辨率。與此相反,用6微米的光電二極管的CCD將完全匹配,以60倍的物鏡,但會產生過采樣的圖像的顯微鏡物鏡轉換器時,是旋轉插入100x物鏡。過采樣以這種方式將大大降低圖像亮度,而未能提高分辨率。
從前面的論述,似乎顯微鏡的光學系統匹配的檢測器的像素分辨率的*理想的解決方案是為每個物鏡使用不同的相機。很明顯,在實踐中,這種策略是不切實際的,必須找到一個折衷優化單個攝像機系統的效用。在某些情況下,通過安裝的物鏡時間倍率的顯微鏡和相機之間的耦合器的分辨率的問題,可以規避。例如,一個0.6倍耦合適配器會降低投影圖像放大100倍的物鏡,以匹配60倍的物鏡。各種各樣的耦合器是從售后市場分銷商,以增加或減少CCD光電二極管陣列平面上的投影放大倍率。轉乘半信半疑上述建議的數字CCD相機方面,重要的是要注意,雖然這些器件可以相對容易地從顯微鏡除去,優選由相機安裝在顯微鏡上的端口,以防止灰塵及碎屑進入身體的顯微鏡,從附著在攝像機圖像傳感器窗口(靜電促進的工件)。清潔傳感器面板窗口是一個不尋常的艱巨的任務,特別是當物鏡是每一個顆粒的灰塵,以徹底清除。
匹配光學顯微鏡分辨率的像素大小的要求
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表1
許多目前的高性能數碼相機系統設計熒光顯微鏡有光電二極管的尺寸范圍從5到16微米和功能芯片分級。正如上面所討論的,離散化的功能,使電荷從幾個相鄰的光電二極管組合成一個更大的單元,其有效地增加了的像素的大小。在6至8微米的光電二極管的尺寸范圍的攝像機,顯微鏡光學分辨率通常可以使用60倍的物鏡沒有分箱匹配,而與100x物鏡,可以提高圖像的亮度,可以利用像素合并成一個2×2陣列的光電二極管。除了趁著匹配的光學系統使用更高的傳輸60X物鏡的CCD分辨率,這種方法允許更明亮的圖像,當使用100倍的物鏡結合分級(2×2分級增加靈敏度四倍)。因此,記錄的圖像與100x物鏡斌2約兩倍明亮的(同等或更好的分辨率),60X沒有分級的物鏡記錄的圖像。額外的靈敏度的情況下,需要或必要時,可以60倍的物鏡分級2×2四個因素來提高亮度,分辨率,通常是可以接受的大多數活細胞成像調查并發虧損。
在一些應用中,如那些需要一個大的細胞群同時監測,捕獲視場的較大部分是更重要的空間分辨率。的矩形的CCD圖像傳感器在數碼相機中,且沒有中間倍率不捕獲整個視場的可視化通過顯微鏡目鏡,而是它被限制為30%和80%之間的范圍內,這取決于芯片尺寸的。是必需的,如果一個較大的視場的時間倍率耦合適配器(如上所述),都可以使用。在許多情況下,一個0.6倍的中繼透鏡將投影圖像的大小,其值接近在目鏡看到的視圖,但在一些成本的分辨率。或者,為了維持分辨率,多個圖像的相鄰的字段可以聚集在高放大倍率,使用x - Y機動掃描階段,隨后縫合在一起成一個較大的圖像,使用采集后處理軟件。
在光學顯微鏡的*大的分辨能力,實現與近紫外光,有效的成像波長*短。近紫外光其次是藍色,綠色,*后變為紅色光的能力來解決標本細節。在大多數情況下,顯微鏡使用廣譜白鎢鹵燈泡產生的光照亮標本,但在活細胞成像的照明往往是有限的頻譜通過窄帶干涉濾光片的應用。在可見光光譜的中心在約550納米,綠色光的主波長(人眼*敏感的綠色光)。它是這樣的波長,被用來計算分辨率值示于表1,所以這些值將不同的或高或低的波長的光時利用。的數值孔徑值更高的數值孔徑也很重要,也將產生更高的分辨率,可以觀察到物鏡表中類似的倍率。
結論
也許*關鍵的活細胞成像方面達到*佳平衡的放大倍率,同時在實驗過程中的信號強度(低倍率的青睞),分辨率(放大倍率越高,所青睞),和細胞活力。研究者必須特別注意*終的光學放大倍率的像素大小的探測器,利用盡可能少的鏡片盡可能匹配。市售光學耦合器具有多種中間放大系數,以匹配特定的物鏡要求(放大倍率和數值孔徑)為輕型限制和高分辨率應用。奈奎斯特分辨率標準時,應嚴格考慮選擇的物鏡放大倍率。應該對應于每個像素的不*過一半所要求的分辨率的限制,由于顯微鏡的衍射極限,這個距離不應小于50納米對于大多數應用程序。
一個標準的干部普遍采用活細胞成像顯微鏡物鏡為10倍和40倍(干),以及40X,60X和100X的油或水浸泡的版本。經濟型干式低倍率鏡頭主要用于標本的初步掃描,以找到感興趣的領域,并不需要高光學校正因素。然而,浸泡鏡片應具有很高的數值孔徑(1.3至1.45的石油和水1.2)和高透光效率。由于圖像的視場的中心附近,高度改正,以生成平坦的字段通常提供沒有可檢測到的好處是明顯更昂貴的和更少的光效率比訂單中的校正物鏡的物鏡通常是聚集。針對熒光成像技術的所有物鏡應該使用熒光珠的點擴散函數的質量檢查。
冷卻黑白CCD攝像機是涉及文化的活細胞成像應用的*佳選擇,無論是否落射熒光或透射光對比度增強(DIC和相襯)是主要的收購模式。在選擇相機時,考慮的重要參數包括量子效率,噪聲水平(暗電流和讀出),像素大小(以及相關的全阱容量),掃描頻率。為了盡量減少水平的激發光,照射在試樣上時,相機應盡可能敏感,這通常意味著量子效率高,噪音低,大的像素大小,掃描速度慢。靈敏度因此,必須對所要求的分辨率(青睞大量的更小的像素)和物鏡成像率(較高的掃描頻率的青睞)平衡。
慢掃描CCD相機一般都限于在他們的幀速率,此外,樣本,除非有非常明亮的熒光,信號噪聲比差時,曝光時間短。這限制了使用這些相機系統用于高速成像應用(高達每秒30幀)和挫敗試圖聚焦樣本。應努力避免漂白和光毒性,文物,可以破壞細胞活力和亮度,找到一個合適的標本,相機對焦時。在這方面,應選擇相機快門的功能,幀轉移或隔行掃描CCD傳感器,這是能夠提供一個連續的流,除了慢掃描數字信號的圖像在視頻速率的。極端的低光照條件下,熒光探針顯示有限的豐度或量子產率較低,再加上捕捉高速運動的要求,可以加劇或電子倍增CCD相機系統需要使用。



